Sēnīšu dermatīts: slimības klīniskā aina, diagnoze un terapijas principi. Sēnīšu otīta etioloģija un ārstēšana
Medicīniskās mikoloģijas problēmas-2000.-Nr.1.-P.4-16.
Sēnīšu infekcijas pacientiem ar novājinātu imunitāti (epidemioloģija, diagnostika, terapija, profilakse)
Markus Ruhnke
Filiāle iekšējā medicīna ar galveno hematoloģijas/onkoloģijas punktu Mercy Campus, Humbolta universitātes Virhovas klīnika, Berlīne
© Markus Ruhnke, 2000
Pēdējo desmitgažu laikā ir bijusi skaidra tendence palielināties sēnīšu infekciju skaitam un attiecīgi palielināt to diagnozes līmeni. Iemesls, kāpēc pēdējo 20 gadu laikā invazīva sēnīšu infekcijas kļūst arvien izplatītākas, bet vēl nav galīgi noteiktas. Tikmēr ir acīmredzams, ka invazīvo sēnīšu infekciju patoģenēzē svarīgi ir faktori, ko nosaka gan pacienta stāvoklis, gan vide. Sēnītes ir vissvarīgākie oportūnistisko infekciju izraisītāji pacientiem ar novājinātu imunitāti. Rakstā aplūkotas oportūnistiskās mikozes, to izraisītāji, diagnostika, ārstēšana un profilakse.
Atslēgvārdi: sēnītes, invazīvas infekcijas, oportūnistiskas mikozes
Sēnīšu infekcijas pacientiem ar novājinātu imunitāti (epidemioloģija, diagnostika, terapija, profilakse)
Markuss Rūnke
Abteilung Innere Medizin mit Schwerpunkt Hamatologie/Onkologie, Charite Campus Virchow Klinikum der Humboldt-Universitat zu Berlin
© Markuss Ruhnke, 2000
Pēdējo divu desmitgažu laikā ir vērojama tendence palielināties sēnīšu infekciju biežumam un attiecīgi uzlabot to diagnostiku. Invazīvās mikozes skaita pieauguma cēloņi nav īsti skaidri. Acīmredzot pacienta dzīves apstākļu faktoriem, kā arī vides faktoriem ir liela nozīme invazīvo sēnīšu slimību patoģenēzē. Sēnītes ir galvenie oportūnistisko mikozes izraisītāji pacientiem ar novājinātu imunitāti. Šajā rakstā ir aprakstītas oportūnistiskās mikozes, to etioloģiskie faktori, diagnostika, terapija un profilakse.
Atslēgas vārdi: sēnītes, invazīvas infekcijas, oportūnistiskas gļotādas
Pēdējo 40 gadu laikā, pateicoties nepārtrauktiem uzlabojumiem un staru ķīmijterapija, ķirurģijas taktika, ļoti nozīmīgi panākumi gūti onkoloģisko un onkohematoloģisko slimību ārstēšanā. Turklāt alogēnās un autologās transplantācijas iespējas kaulu smadzenes(BMT), kā arī cieto orgānu transplantācija palielina vēža pacientu atveseļošanās iespējas (1. tabula). Šīs ārstēšanas ietvaros tiek izmantotas ne tikai citostatiskas, bet arī imūnsupresīvas zāles, lai nodrošinātu transplantāta darbību. Tomēr komplikācijas sēnīšu infekciju veidā nav nekas neparasts. bakteriālas infekcijas, īpaši pacientiem ar neitropēniju un/vai imūnsupresiju. Turklāt pacienti ar iegūto vīrusu imūndeficīts, komplikācijas pēc vēdera ķirurģiskas iejaukšanās, plaši smagi apdegumi, kā arī priekšlaicīgi dzimuši jaundzimušie ar mazu ķermeņa masu un jaundzimušie, kuri tika ārstēti pirmajās dzīves dienās intensīvā aprūpe (parenterālā barošana un masveida antibakteriālā terapija).
1. tabula.
Sēnīšu slimības cieto orgānu transplantācijā
| Patogēns | Slimība | ||
| aknu transplantācija | sirds-plaušu kompleksa transplantācija | nieru transplantācija | |
|
Aspergillus spp. Candida spp. Cryptoccus neoformans Pneumocystis carinii |
Brūču infekcija Smadzeņu abscess Fungēmija Peritonīts Žultsceļu infekcija Brūču infekcija Meningīts (reti) Pneumocystis pneimonija |
Invazīva plaušu aspergiloze Čūlains traheobronhīts Brūču infekcija (sternotomijas zona) Smadzeņu abscess (reti) Fungēmija Brūču infekcija Meningīts Pneumocystis pneimonija |
galvenokārt raksturo kandidēmija |
No saistītie faktori invazīvu sēnīšu infekciju attīstības risku var saukt par: antibiotikām plaša spektra, parakstīts ilgāk par 14 dienām, kalorijām bagāts parenterāls uzturs, ilgstošs mākslīgā ventilācija plaušas (ventilators), šoks, plaši apdegumi, iepriekšējās sēnīšu infekcijas, kortikosteroīdi, H2 receptoru blokatori, bakteriāla sepse.
Invazīvu sēnīšu infekciju cēloņi
Biežākie sēnīšu infekciju izraisītāji ir Candida un Aspergillus ģints sēnes, retāk - Fusarium spp., zygomycetes, Trichosporon beigelii, Cryptococcus neofomans. Inficēšanās ar Aspergillus un citām pavedienveida sēnēm parasti notiek, ieelpojot gaisā esošās sēnīšu sporas. Kolonizācija kuņģa-zarnu trakta rauga sēnītes, piemēram, Candida spp., var izraisīt saprofītiskā mikobiota vai nozokomiālie patogēni ar neapmierinošu roku ārstēšanu medicīnas personāls. Aspergillus spp. ko raksturo invazīva augšana caur bronhiem uz plaušu audi ar sakāvi asinsvadi un sekojoša asiņošana, nekroze un plaušu parenhīmas infarkts.
Neitrofilo granulocīti, monocīti un makrofāgi ir galvenā saikne makroorganisma aizsardzības mehānismos pret Candida spp. un Asperillus spp., un ilgstoša neitropēnija, ko izraisa citostatiķi, rada īpašu apdraudējumu pacientam. Ar smagu ilgstošu neitropēniju (<0,1х109/л >10 dienas) pastāv Lieliska iespēja smagas izplatītas sēnīšu infekcijas attīstība, kas bieži beidzas ar pacienta nāvi (2. tabula). Papildu riska faktors smagas izplatītas sēnīšu infekcijas attīstībai ir lietošana lielas devas kortikosteroīdus, jo šīs zāles izraisa imūno šūnu disfunkciju un var arī stimulēt Asperillus spp.
2. tabula.
Sēnīšu slimības pacientiem ar neitropēniju
| Patogēns | Slimība |
| Aspergillus spp. (aspergiloze) |
Traheobronhīts Invazīva plaušu aspergiloze Izplatīta infekcija, kas skar centrālo nervu sistēmu un/vai aknas un liesu Ādas bojājumi Paranasālo sinusu iesaistīšanās (reti) |
| Candida spp., galvenokārt C. albicans (kandidoze) |
Candida ezofagīts Fungēmija Sepse Plaušu kandidoze Ādas bojājumi Endoftalmīts |
| Fusarium spp. (fuzārijs) |
Ādas bojājumi Fungēmija Pneimonija Sinusīts |
| Zigomicīti: Rhizopus, Mucor, Rhizomucor, Absidia spp. (zigomikoze) |
Sinusīts Pneimonija Smadzeņu abscess Izplatīta infekcija Ādas bojājumi (reti) |
| Scedosporium spp., galvenokārt S.apiospermum (scedosporium) | Smadzeņu abscess Ādas bojājumi Kaulu un/vai mīksto audu iesaistīšanās (reti) |
| Trichosporon spp., galvenokārt T.beigelii (trichosporonosis) |
Fungēmija Pneimonija Endokardīts Hroniska izplatīta infekcija (reti) |
Cīņā pret sēnīšu infekciju svarīga loma Spēlē arī T-limfocīti (CD4+ šūnas). Ar T-šūnu imūndeficītu palielinās Pneumocystis carinii, Cryptococcus neoformans, kā arī Eiropā retu endēmisku patogēnu, piemēram, Histoplasma capsulatum, izraisītu infekciju attīstības iespējamība.
HIV infekcijas laikā T-limfocītu skaits pakāpeniski samazinās, tāpēc risks saslimt ar kādu no šīm infekcijām, bieži vien ar letālu iznākumu šādiem pacientiem, ir ļoti nopietns (3. tabula).
3. tabula.
Sēnīšu infekcijas HIV inficētiem pacientiem
Histoplasma capsulatum
| Patogēns | Slimība |
| Aspergillus spp. |
Aspregillus tracheobronhīts Invazīva plaušu aspergiloze |
| Candida spp. (galvenokārt C. albicans) |
Mutes un/vai maksts kandidoze Candida ezofagīts Candida sēnīte Plaušu kandidoze (galvenokārt bērniem) |
| Coccidioides immitis |
Izplatīta kokcidioidomikoze |
| Cryptoccus neoformans |
Kriptokoku meningīts Kriptokoku pneimonija Izplatīta kriptokokoze |
| Histoplasma capsulatum |
Histoplāzijas pneimonija Izkliedēta histoplazmoze |
| Pneumocystis carinii | Pneumocystis pneimonija; beigu stadijā vai uz profilakses fona - nespecifisks attēls, ieskaitot vairākus orgānu bojājumus |
| Penicillium marneffei |
Ādas peniciloze Izkliedēta peniciloze (endēmiska Dienvidaustrumāzijas reģionā) |
Invazīvas sēnīšu infekcijas attīstības risku pacientiem nosaka divas faktoru grupas, no kurām katra ir svarīga, un to kombinācija ir īpaši bīstama:
- Faktori vidi: pavedienu sēņu (tostarp Asperillus spp. sporu) sporu klātbūtne gaisā būvniecības un remontdarbu laikā un sienu plaisās (pagrieziens Īpaša uzmanība par klīnikas stāvokli); pelējuma klātbūtne uz istabas augi, kuras saturs būtu stingri aizliegts nodaļās, kur atrodas pacienti ar neitropēniju; pelējuma klātbūtne pārtikā (ieskaitot riekstus, maizi, salātus, augļus, garšvielas - piemēram, papriku). Raugam līdzīgas sēnes (galvenokārt Candida ģints) var izraisīt tipisku nozokomiāla infekcija patogēnu šūnu klātbūtnes dēļ uz nepietiekami apstrādātām personāla rokām; Šī iemesla dēļ ir iespējama arī pārtikas produktu (galvenokārt augļu sulu) piesārņojums.
- Faktori, kas saistīti ar pacienta stāvokli: parasti sēnīšu infekcijas attīstības risku nosaka daudzi faktori, kas var darboties kā sinerģisti; pacientiem ar ļaundabīgi audzēji papildus riska faktori ir ilgstoša citopēnija pēc polihemoterapijas, traucējumi šūnu imunitāte un sēnīšu, galvenokārt Candida spp., kolonizācijas smagums organismā. (ietekmē vairāk nekā divas ķermeņa zonas).
Pareizajai stratēģijai jābūt riska līmeņa noteikšanai katrai pacientu grupai; veicot attiecīgus diagnostikas pasākumi ne vairāk kā agrīnie simptomi Un agrs sākums adekvāta terapija. Jāatceras, ka līdz noteiktam brīdim no pamatslimības sākuma riska grupas pacientiem var attīstīties sēnīšu komplikācijas (1. att., 2. att., 3. att.).
Invazīvu sēnīšu infekciju patogēni
Sēnīšu infekcijas, kas rodas pacientiem ar novājinātu imunitāti, iedala trīs galvenajās kategorijās:
Izraisa visbiežāk sastopamās Candida un Aspergillus ģints oportūnistiskās sēnes, kas var būt virspusēju ādas un gļotādu bojājumu izraisītāji pacientiem bez imūndeficīta;
Izraisa obligātie patogēni - Histoplasma capsulatum, Coccidiodes immitis, kas var rasties pacientiem bez imūndefektiem. Šie patogēni spēj izraisīt smagas izplatītas infekcijas pacientiem ar AIDS un onkoloģiskās slimības. Pastāv viedoklis, ka šīs infekcijas, kas attīstījušās pēc citostatiskās terapijas, lielākoties ir latentas infekcijas reaktivācija. Pacienti ar HIV infekciju un ļaundabīgām limfomām ir īpaši uzņēmīgi pret šo patogēnu iedarbību;
Izraisa retas oportūnistiskas sēnes:
- feohifomikoze, kuras izraisītāji ir, piemēram, Curvularia spp., Bipolaris spp., Alternaria spp.;
- hialohifomikoze, ko izraisa Fusarium spp., Scedosporium apiospermum;
- zigomikoze, ko izraisa Rhizopus spp., Mucor spp., Absidia spp.
Aspergiloze
Aspergillus ģints micēlijas sēnes dabā ir visuresošas. No viņiem augstākā vērtība ir Aspergillus fumigatus (apmēram 90% no aspregillus izraisītajām slimībām), A. niger (infekcijas auss kanāls), A. flavus (kolonizācija un deguna blakusdobumu infekcija), kā arī A. terreus un A. nidulans.
Līdz 70. gadu sākumam aspergiloze bija reta, slikti aprakstīta infekcija pacientiem ar vēzi un onkohematoloģiskām slimībām. Tomēr, palielinoties ķīmijterapijas intensitātei un ieviešot kaulu smadzeņu un cieto orgānu transplantāciju, invazīvās aspergilozes sastopamība ir palielinājusies. Sākotnēji šādas komplikācijas tika novērotas gandrīz tikai pacientiem ar refraktāru akūtu mieloīdu leikēmiju (AML), vēlāk aspergiloze sāka attīstīties pacientiem ar neitropēniju pēc intensīvas AML remisijas indukcijas.
Kandidoze
Invazīvās infekcijas, ko izraisa Candida ģints pārstāvji (galvenokārt C. albicans), ir biežākās mikozes pacientiem ar onkohematoloģiskām slimībām daudzās klīnikās. Retāk sastopamas C. tropicalis, C. krusei, C. glabrata, C. parapsilosis vai C. guilliermondii. Dažās klīnikās C. tropicalis un C. glabrata ir kļuvušas īpaši nozīmīgas, izraisot infekciju saistīta ar centrālo vēnu katetru. Candida spp., kas nav saistītas ar C. albicans, īpatsvara pieaugums var būt saistīts ar plašu profilaktiska lietošana flukonazols. Lielāko daļu šo infekciju izraisa endogēna kolonizācija, lai gan dažkārt tiek atzīmēta to nozokomiālā izcelsme. Vissvarīgākais invazīvās kandidozes riska faktors ir ilgstoša granulocitopēnija.
Kandidoze, atšķirībā no aspergilozes, var attīstīties virspusējas un invazīvas infekcijas. Salīdzinoši nesen tika aprakstīta iepriekš nezināma Candida dubliniensis suga, kas visbiežāk konstatēta HIV inficētu pacientu rīkles uztriepes. Šo patogēnu var izolēt arī no pacientiem ar granulocitopēniju. Priekšlaicīgi dzimušiem jaundzimušajiem ar mazu ķermeņa masu kopīgs cēlonis ar katetru saistītā fungēmija ir C. parapsilosis.
Citas sēnīšu infekcijas
Citas ievērojamas sēnīšu infekcijas ir zigomikoze (mukoroze) un kriptokokoze. Pēdējais Vācijā rodas tikai pacientiem ar AIDS. Attiecībā uz sastopamības biežumu zigomikoze nāk pēc kandidozes un aspergilozes. Visbiežākais zigomikozes izraisītājs ir Rhizopus arrhizus. Šīs slimības sākums atgādina aspergilozi. Inficēšanās notiek, ieelpojot ar gaisā esošām patogēna sporām, pēc tam deguna blakusdobumu deguns un plaušas, retāk - āda.
IN pēdējie gadi pacientiem ar ļaundabīgas slimības Ir novērots retu sēnīšu infekciju (hialohifomikoze, feohifomikoze, trihosporonoze) skaita palielināšanās. Šādas infekcijas ir īpaši izplatītas lielos pētniecības centriem ASV. Konstatēts, ka līdz šim par nepatogēnām uzskatītās “nekaitīgās” sēnītes, piemēram, Geotricum candidum (“piena pelējums”), Sacchormyces cerevisia (maizes raugs), Rhodotorula spp., var izraisīt letālas infekcijas pacientiem ar imūndeficītu.
Invazīvu sēnīšu infekciju sastopamība
Aspergiloze
Invazīvo aspergilozi (IA) visbiežāk novēro pacientiem ar granulocitopēniju AML un BMT izraisītas citostatiskas zāles- līdz 20% pacientu. Retāk IA novēro pacientiem pēc aknu transplantācijas (5–15%), sirds-plaušu transplantācijas (10%) un nieru transplantācijas (<5%). Наиболее частой формой ИА является инвазивный легочный аспергиллез (ИЛА).
IA sastopamības atšķirības dažādās pacientu kategorijās izraisa dažādas imūnsupresīvās (tostarp kortikosteroīdu) terapijas intensitātes. Ilgstošas neitropēnijas kombinācija ar intensīvu zāļu imūnsupresiju ir galvenais riska faktors. Tomēr IPA sastopamība pēc BMT pēdējos gados samazinās un saskaņā ar dažiem datiem ir mazāka par 5%; Iespējams, tas ir saistīts ar ļoti efektīvas gaisa attīrīšanas izmantošanu, izmantojot HEPA filtrus (High Effective Purification Air) un agrīnu pretsēnīšu zāļu lietošanas sākšanu – jau pie pirmajām aizdomām par aspergilozi. Neskatoties uz to, Sietlas BMT centrs ziņo par pastāvīgu aspergilozes sastopamības pieauguma tendenci no 5,7% 1987. gadā līdz 11,2% 1993. gadā (dati no 2496 transplantācijas pacientiem). Jebkurā gadījumā "zemajam" IA biežumam nevajadzētu radīt drošības sajūtu, jo dažās pacientu kategorijās šīs slimības mirstība var pārsniegt 90%.
Sēnīšu infekciju biežums klīnikās Frankfurtē pie Mainas, saskaņā ar 8124 autopsijām, palielinājās no 2,2% 1978. gadā līdz 5,1% 1991. gadā. Šo pieaugumu galvenokārt noteica aspergiloze, kuras biežums šajā periodā pieauga no 0,4% līdz 3,1%. Aspergiloze tika konstatēta galvenokārt vēža slimniekiem - vairāk nekā 40% un AIDS pēdējā stadijā - 39%.
Kandidoze
Mutes un rīkles kandidoze (mutes piena sēnīte) rodas aptuveni 30% vēža pacientu pēc ķīmijterapijas un vairāk nekā 90% pacientu ar AIDS, un kandidoze viņiem var būt nopietna problēma. Candida ezofagītu konstatē aptuveni 20% pacientu ar AIDS, un aptuveni 11% no viņiem tas ir pirmais šīs slimības simptoms. Kandidozā ezofagīta biežums vēža, onkohematoloģiskās slimības un transplantācijas pacientiem nav precīzi zināms. Izgulsnēšanās faktori parasti ir antibiotikas, ko pacientiem izraksta nezināmas izcelsmes drudža gadījumā, un glikokortikoīdi, ko izraksta transplantāta pret saimniekorganismu slimības ārstēšanai pēc alogēnas KMT vai atgrūšanas pēc cieto orgānu transplantācijas.
Invazīvā kandidoze rodas pacientiem pēc BMT aptuveni 25% gadījumu, parasti neitropēnijas laikā, 1 līdz 2 nedēļas pēc BMT. Mirstība no kandidēmijas sasniedz 40%, bet no vairākiem orgānu bojājumiem – 90%.
Pēc aknu transplantācijas invazīvā kandidoze tiek novērota 18–30% gadījumu, un mirstība pārsniedz 75%. Riska faktori ir transplantāta atgrūšana un vēdera infekcija.
Pacientiem ar AIDS galvenokārt tiek novērota virspusēja kandidoze, kandidūrija un infekcija, kas saistīta ar centrālo vēnu katetru.
Citas sēnīšu infekcijas.
Papildus iepriekš minētajai zigomikozei kriptokokozei ir svarīga klīniska nozīme. Visbiežāk kriptokokozi novēro pacientiem ar AIDS. Atkarībā no reģiona šī infekcija ir konstatēta 5–12% šādu pacientu, un aptuveni 4% CNS kriptokokoze ir AIDS izpausme. Pacientiem ar neitropēniju šī slimība ir ļoti reta un neietilpst obligātajā diferenciāldiagnozē nezināmas izcelsmes drudža sindroma gadījumā.
Tomēr pacientiem ar limfoproliferatīvām slimībām (Hodžkina slimību, hronisku limfoleikozi), īpaši tiem, kas tiek ārstēti ar fludarabīnu, kriptokokozes sastopamība var sasniegt 8%. Jau minētajā patoloģiskajā pētījumā kriptokokoze tika konstatēta tikai 8 gadījumos no 8124 autopsijām, un visiem šiem pacientiem bija AIDS; Starptautiskā patoloģiski-anatomiskā pētījumā no 265 visu sēnīšu infekciju gadījumiem kriptokokoze konstatēta 9 gadījumos.
Cieto orgānu transplantācijā saslimstība ar kriptokokozi sasniedz 3%. Vairumā gadījumu klīniskā aina atbilst hroniskam meningītam, pirms tam ir plaušu simptomi.
Invazīvo mikožu klīnika, diagnostika, ārstēšana un profilakse
Aspergiloze
Aspergilozi var iedalīt trīs kategorijās:
- virspusējas - auss kanāla, radzenes infekcijas, kā arī primārie ādas bojājumi;
- neinvazīvs - alerģisks bronhīts un aspergiloma pacientiem ar iepriekšēju kavernozu plaušu slimību (galvenokārt tuberkulozi);
- invazīvs - parasti tiek konstatēts pacientiem ar neitropēniju; izšķir tikai akūtu invazīvu un hronisku nekrotizējošo formu.
Akūta invazīva aspergiloze pacientiem ar novājinātu imūnsistēmu ir vissmagākā slimības forma, kurā sēnītes iekļūst plaušu un/vai deguna blakusdobumu audos. No šejienes iespējama izplatīšanās uz citiem orgāniem - piemēram, centrālo nervu sistēmu, aknām, nierēm. Invazīva plaušu aspergiloze var rasties kā lokāls vai difūzs plaušu parenhīmas bojājums (visbiežāk leikēmijas gadījumā un pēc KMT) un/vai kā čūlains traheobronhīts (biežāk rodas plaušu transplantācijas un AIDS gadījumā). Slimības gaita bieži ir zibenīga.
Vissvarīgākais prognostiskais faktors, kas nosaka pacienta likteni, ir normāla granulocītu skaita ātra atjaunošana. Izplatība tiek novērota aptuveni 25% pacientu ar invazīvu plaušu aspergilozi.
Hroniska nekrotizējoša aspergiloze norit ilgāk un biežāk sastopama pacientiem bez granulocitopēnijas vai pēc asinsrades atjaunošanas.
Galvenie plaušu bojājumu simptomi ir klepus un pakāpeniski pieaugošs elpas trūkums; ar aknu bojājumiem - kontrolēto enzīmu līmeņa paaugstināšanās serumā. Bez ārstēšanas hroniska nekrotizējoša aspergiloze var būt letāla.
Invazīvās aspergilozes diagnozi ir grūti noteikt, kamēr pacients ir dzīvs.
Imunokompetentiem pacientiem šī infekcija parasti norit nepamanīta.
Riska grupas pacientiem, parādoties pirmajiem aizdomīgajiem simptomiem, jums jādomā par invazīvu sēnīšu infekciju.
Tipiski invazīvas aspergilozes klīniskie simptomi pacientiem ar neitropēniju ir akūtas vienpusējas sāpes pleirā, klepus, elpas trūkums un retāk hemoptīze auskulācijas laikā, tiek novērotas tādas pašas izmaiņas kā pleiropneimonijas gadījumā. Ar plaušu emboliju jāveic diferenciāldiagnoze. Bieži vien pirmais invazīvas sēnīšu infekcijas simptoms ir pret antibiotikām neizturīgs neitropēnisks drudzis, kā arī mezglu infiltrāti plaušu rentgenogrammās un datortomogrammās, nezināmas etioloģijas sinusīts vai deguna asiņošana, sāpes un pietūkums periorbitāli, ādas bojājumi (sēnīšu embolija), centrālās daļas. nervu sistēmas bojājumi, piemēram, abscesa gadījumā (neiroloģiski simptomi, apjukums).
Paranasālo blakusdobumu aspergiloze un izplatītā aspergiloze, tostarp tās, kas ietekmē centrālo nervu sistēmu, ir daudz retāk sastopamas nekā invazīvā plaušu aspergiloze. Nezināmas izcelsmes ādas izmaiņas papulāru elementu veidā ar centrālo nekrozi var liecināt par izplatītu aspergilozi, un ir nepieciešama biopsija.
Krūškurvja orgānu rentgenstari ne vienmēr atklāj raksturīgas izmaiņas. Nodulāru vai retāk difūzu infiltrātu noteikšanai nepieciešama datortomogrāfija, lai izslēgtu invazīvo aspergilozi. Ar datortomogrāfiju dati ir ļoti raksturīgi un tiek konstatēti agrāk nekā ar krūškurvja rentgenu. Raksturīgs ir mezglains infiltrāts ar “loka” simptomu.
Skaidras IA pazīmes parasti parādās tikai pēc granulocitopēnijas beigām. Dažos gadījumos IA diagnozi var veikt, tikai pamatojoties uz biopsijas rezultātiem, ko hematopoētiskās aplāzijas periodā ir diezgan grūti veikt. Tāpēc daudzās klīnikās tiek izmantota bronhoskopija (ar bronhoalveolāru skalošanu), kas var iegūt nepieciešamo materiālu pētniecībai. Papildus bronhoskopijai materiālu var iegūt, izmantojot transtorakālo biopsiju ar smalku adatu.
Jauna diagnostikas metode ir polimerāzes ķēdes reakcijas (PCR) izmantošana, ko izmanto, lai pārbaudītu materiālu, kas iegūts no bronhoalveolārās skalošanas vai punkcijas. Ir iespējams arī noteikt specifisku DNS, izmantojot PCR asinīs. Mikrobioloģiskajā izmeklēšanā ļoti reti tiek konstatēta patogēna klātbūtne asins kultūrā; Regulāri seroloģiskie testi arī nav pietiekami efektīvi. Nesen tika izlaists jauns seroloģiskās pārbaudes diagnostikas tests (Platelia-Assay?, Fa. Paster), kura izmantošana šķiet ļoti daudzsološa.
Invazīva aspergiloze bez ārstēšanas vienmēr ir letāla. Augsta riska pacientiem arī antimycotic terapija ne vienmēr ir veiksmīga. Terapijas efektivitāte dažādās pacientu grupās atšķiras. Pētījumā, kurā piedalījās 2121 pacients, tika pierādīts, ka starp pacientiem, kuri tika ārstēti ar amfotericīnu B ilgāk par 14 dienām, terapija bija veiksmīga 50% gadījumu; aprēķinot rezultātus, ņemot vērā pacientus, kuri miruši agrāk par 14. ārstēšanas dienu, efektivitāte bija tikai 30%; sliktākie rezultāti tika iegūti pacientiem ar centrālās nervu sistēmas bojājumiem, no kuriem 95% nomira. Saskaņā ar Denninga (1990) teikto, mirstības līmenis bija: 90% BMT, 77% leikēmijas, 50% nieru transplantācijas, 50% sirds transplantācijas, 93% aknu transplantācijas, 87% AIDS gadījumā.
Tā kā slimības prognoze ir tik nelabvēlīga, tad, ārstējot to, jāievēro šādi noteikumi: pēc iespējas agrāk aizdomas par aspergilozi un diagnosticēt to; nekavējoties sākt antimycotic terapiju; censties ātri atjaunot granulocītu līmeni un atcelt (ja iespējams, samazināt devu) kortikosteroīdus.
4. tabula.
Sēnīšu infekciju diagnostika un ārstēšana pacientiem ar novājinātu imunitāti
| Slimība | Diagnostika | Ārstēšanas izvēle | komentāri |
| Aspergiloze | |||
| Invazīva infekcija |
datortomogrāfija |
Amfo-B+flucitozīns Ambizom |
|
| Kandidoze | |||
| Mutes dobuma un rīkles bojājumi | Mikroskopija un kultūra (uztriepes un uztriepes) |
Amfo-B balstiekārta per os Flukonazols per os |
Smagos gadījumos ir norādīta parenterāla barošana. |
| Barības vada bojājums | Ezofagoduodenoskopija ar biopsiju (histoloģiskā analīze un kultūra) |
Amfo-V i.v. Flukonazols per os / itrakonazols HIV ārstēšanai |
Var rasties sugas, kas ir izturīgas pret flukonazolu/ itrakonazols |
| Maksts bojājums | Mikroskopija un izdalījumu kultūra | Klotrimazola svecītes |
Recidīvi imūnsupresijas dēļ, C.glabrata in HIV |
| Urīnceļu infekcijas | Mikroskopija un urīna kultūra |
Flukonazols per os IV: flukonazols vai Amfo-B |
Ja iespējams, izņemiet urīnceļu katetru |
| Kandidēmija | Asins kultūra | Amfo-B+flucitozīns |
Ja iespējams, noņemiet centrālo vēnu katetru Alternatīva: Ambizom |
| Hroniska izplatīta infekcija | Biopsija (histoloģija un kultūra) | Flukonazols per os, ja patogēns ir jutīgs pret to, vai Ampho-B i.v. | |
| Plaušu bojājumi | Biopsija (histoloģiskā analīze un kultūra) | Amfo-B+flucitozīns | Diagnoze bieži ir sarežģīta |
| Fusarium | |||
| Izplatīta infekcija | Biopsija (histoloģiskā analīze un kultūra) + asins kultūra |
Amfo-B+flucitozīns Ambizom |
Nepieciešama steidzama granulocītu līmeņa atjaunošana |
| Kriptokokoze | Cerebrospinālā šķidruma mikroskopija; cerebrospinālā šķidruma kultūra, asinis, urīns, bronhoalveolāra skalošana. |
Seroloģija Amfo-B+flucitozīns Flukonazols IV Ambizom |
Seroloģiskā diagnostika (antigēna noteikšana, īpaši cerebrospinālajā šķidrumā) ir ļoti informatīva |
| Zigomikoze | |||
| Sinusīts, smadzeņu abscess, pneimonija, izplatīta infekcija | Biopsija (histoloģiskā analīze + mikrobioloģiskie pētījumi) |
Amfo-V Ambizom |
Ir indicēta agrīna operācija, histoloģiski līdzīga aspergilozei |
| Scedosporiasis (Scedospodium apiospermum) |
|||
| Ādas, kaulu, smadzeņu, mīksto audu infekcijas bojājumi | Biopsija (histoloģiskā analīze un kultūra) |
Itrakonazols Mikonazols (atsevišķos gadījumos) |
Ir indicēta agrīna operācija, histoloģiski līdzīga aspergilozei un fuzariozei |
| Feohifomikoze | |||
| Ādas infekcija, centrālā nervu sistēma | Biopsija (histoloģiskā analīze un kultūra) | Amfo-B+flucitozīns Itrakonazols | Agrīna operācija norādīta |
Pašlaik izvēlētā ārstēšana ir intravenoza amfotericīna B vai liposomu amfotericīna B ambisoma. Ir veikti mēģinājumi kombinēt terapiju ar flucitozīnu, taču nav iegūta ticama šo zāļu sinerģiska iedarbība.
Tā kā amfotericīnu B lieto vairāk nekā 40 gadus, tā audu farmakokinētika, efektivitāte un blakusparādības ir pētītas jau sen. Blakusparādības ir nefrotoksicitāte un infūzijas reakcijas: drudzis, drebuļi un bronhu spazmas.
IA gadījumā nepieciešamā amfotericīna B deva ir 1 mg/kg/dienā, maksimālā deva ir līdz 1,5 mg/kg/dienā. Ir amfotericīna B lietošanas metode, kurā sākotnējā deva ir 0,1 mg/kg/dienā, pakāpeniski palielinot (2–3 dienu laikā) līdz terapeitiskajai devai. Tomēr šī metode nav piemērota augsta riska pacientiem, jo pacientam nepieciešama tūlītēja ārstēšana. Alternatīva ir 1 mg izmēģinājuma ievadīšana 30 minūšu laikā, kam seko pilna dienas deva. Dažās klīnikās pilnu devu (1 mg/kg) ievada pirmajā ārstēšanas dienā bez izmēģinājuma.
Amfotericīna B ievadīšanai vajadzētu ilgt 2 līdz 4 stundas. Smagas nevēlamas reakcijas gadījumā ir indicēta profilaktiska (vai, ja parādās nevēlami simptomi) antihistamīna, difenīna un ļoti smagos gadījumos kortikosteroīdu ievadīšana.
Charite klīnikas Onkoloģijas un hematoloģijas nodaļā (Humboldta Universitāte, Berlīne), kurā strādā raksta autore, tiek lietota profilaktiska paracetamola ievadīšana un lēna difenīna infūzija - 10–20 mg/stundā ar perfuzoru. Kortikosteroīdus izraksta tikai izņēmuma gadījumos. Šī taktika ļauj daudziem pacientiem izvairīties no akūtām blakusparādībām. Gadījumos, kad to nevar panākt un rodas hemodinamikas traucējumi, pacienti saņem Ambizom. Lietojot šīs zāles, tiek novērsta arī amfotericīna B nefrotoksiskā iedarbība.
Citas amfotericīna B lipīdu formas ir ierosinātas kā alternatīvas zāles: koloidālā dispersija (amfocils) un lipīdu komplekss (Abelset). Šīs zāles Vācijā nav izmantotas, un to patiesā nozīme joprojām nav skaidra. To ikdienas lietošana ir sarežģīta, galvenokārt augstās cenas dēļ. Šķiet, ka invazīvas aspergilozes efektivitāte salīdzinājumā ar amfotericīnu B ir augstāka vai salīdzināma; tas, iespējams, ir saistīts ar devu: 3–5 mg/kg Ambisom, 3 mg/kg Amphocil un 5 mg/kg Abelset.
Tā sauktais “mājas maisījums”, kas sastāv no amfotericīna B un tauku emulsijām parenterālai barošanai, tā zemo izmaksu dēļ tika izmantots kādu laiku, bet pēc tam tika aizliegts iegūtā maisījuma nestabilitātes dēļ un, pats galvenais, jo no ziņotajām plaušu toksicitātes epizodēm.
Galvenā Ambizom priekšrocība ir tā zemā nefrotoksicitāte. Parastā amfotericīna B, liposomālā amfotericīna B un amfotericīna B farmakokinētiskās īpašības koloidālā dispersijā un lipīdu kompleksā atšķiras.
Alternatīva ir azola atvasinājumu izmantošana, kas ir pierādījuši savu efektivitāti iepriekšējos pētījumos - ar itrakonazolu un vorikonazolu, pēdējā pašlaik tiek veikti klīniskie pētījumi. Itrakonazola īpašības ir tādas, ka nepieciešamā “piesātinājuma deva” ir 600–800 mg pirmajās piecās dienās, un pašlaik tas ir komerciāli pieejams tikai iekšķīgi, un tā absorbcija ir salīdzinoši vāja. Itrakonazola klīnisko nozīmi var definēt ar terminu “uzturošā terapija”, tas ir, pacienti tiek pārcelti uz itrakonazolu pēc tam, kad ir sasniegts amfotericīna B terapeitiskais efekts Tabula. 4. Invazīvo sēnīšu infekciju ārstēšanas algoritms ir parādīts attēlā. 4 .
Paralēli medikamentozai ārstēšanai veselības apsvērumu dēļ (piemēram, draudoša asiņošana no sēnīšu invāzijas bojātiem traukiem) tiek veikta ķirurģiska iejaukšanās, ko var efektīvi veikt pat hematopoētiskās aplāzijas periodā. Komplikāciju biežums pēc krūšu kurvja operācijām aplāzijas dēļ ir zems, ja tiek nodrošināts transfūzijas atbalsts ar trombocītu koncentrātu un sarkanajām asins šūnām.
Nozokomiālā IA visbiežāk skar pacientus, kuri saņēmuši mieloablatīvo terapiju akūtas leikēmijas vai BMT ārstēšanai. Tā kā Aspergillus spp. atrodas dzīvojamo telpu gaisā, ir jāveic profilaktiski pasākumi, kuru mērķis ir samazināt sporu koncentrāciju gaisā vai to pilnīgu izvadīšanu. Tas galvenokārt attiecas uz TCM nodaļām. Lai to izdarītu, tiek izmantotas šādas metodes: ļoti efektīva gaisa attīrīšana, izmantojot HEPA filtrus, gaisa padeve telpā zem augsta spiediena (gaiss tiek pastāvīgi “izspiests” caur īpašām atverēm kopā ar putekļiem, sēnīšu sporām utt.) un telpām. ar lamināru gaisa plūsmu. Ieteikumus nozokomiālās invazīvās aspergilozes profilaksei izstrādāja ASV Slimību kontroles un profilakses centri.
Narkotiku profilaksei augsta riska pacientiem joprojām nav standarta risinājuma. Agrāk lielas cerības tika liktas uz lokālo (nazālo vai inhalējamo) amfotericīnu B, taču tas izrādījās neefektīvs. Amfotericīna B intravenozas profilaktiskās lietošanas nozīme vēl nav skaidra, jo nav veikti randomizēti pētījumi. Parasti zāles ordinē devā 0,3-0,5 mg/kg/dienā 3 reizes nedēļā. Iespējams, ka šādas profilakses rezultātā var samazināties invazīvās aspergilozes sastopamība, taču toksicitātes dēļ var samazināties arī kopējā pacientu dzīvildze. Tomēr daudzas klīnikas izmanto šādu profilaksi.
Vēl viena iespēja ir perorāla profilakse ar itrakonazolu (200–600 mg dienā), kas ir pierādīts, ka randomizētos pētījumos samazina invazīvu sēnīšu infekciju (ne tikai aspergilozes) sastopamību. Itrakonazolam nav būtiskas toksicitātes, taču, lietojot zāļu iekapsulēto formu, terapeitiskā koncentrācija asins plazmā ne vienmēr tiek sasniegta. Pamatojoties uz šiem farmakoloģiskajiem apsvērumiem, tika ierosināts izmantot tikai itrakonazola šķīdumu. Tā kā ir zināms, ka nepieciešamā koncentrācija tiek sasniegta nedēļas laikā, terapija jāsāk ar lielām devām (t.i., 800 mg/dienā 5-7 dienas); citas pazīmes ir aprakstītas citos pētījumos.
Kandidoze
Kandidozes klīniskā aina var izpausties kā:
- virspusēja gļotādu un/vai ādas infekcija, piemēram, mutes kandidoze;
- kandidēmija ar patogēna izdalīšanos no asinīm;
- akūta diseminēta infekcija ar orgānu bojājumiem, piemēram, endoftalmīts, endokardīts;
- hroniska izplatīta infekcija, piemēram, hepato-lienal kandidoze.
Dažiem pacientiem pēc KMT granulocitopēnijas periodā var attīstīties izplatīta kandidoze ar aknu, liesas, nieru, sirds, kuņģa-zarnu trakta, plaušu, smadzeņu un ādas bojājumiem. Patogēni šeit ir C. albicans (7%-12%), citas Candida sugas - galvenokārt C. tropicalis (25%-38%).
Hepato-lienālā kandidoze ir forma, kas raksturīga pacientiem ar granulocitopēniju, ko parasti pavada sākotnēji neitropēnisks drudzis, kas nav rezistents pret antibiotikām ar vai bez patogēna noteikšanas asins kultūrā. Paaugstinoties granulocītu līmenim, drudzis parasti apstājas, bet parādās hiperfermentēmija un raksturīgas radioloģiskās aknu un liesas bojājumu pazīmes (datortomogrāfija, magnētiskās rezonanses attēlveidošana).
Gļotādu kandidoze, kas ietekmē mutes rīkli, barības vadu un maksts, parasti ir viegli atpazīstama makroskopiski raksturīgā baltā pārklājuma dēļ. Tipiski simptomi ir sausa mute, slāpes, dedzināšana skartajās vietās, disfāgija un izdalījumi no maksts.
Lai apstiprinātu diagnozi, ir nepieciešama mikroskopiskā izmeklēšana. Par kolonizāciju tiek uzskatīta situācija, kad patogēns tiek atrasts divās vai vairākās dažādās ķermeņa zonās. Šādā situācijā invazīvas kandidozes attīstības risks ir augsts.
Candida sugu atpazīšana mikrobioloģiskās izmeklēšanas laikā ir nepieciešama šādu iemeslu dēļ: infekcija, ko izraisa dažas Candida ģints sēnes, kas nav radniecīgas ar C. albicans sugām, biežāk izplatās un ir smagākas, ar augstāku mirstības līmeni. Turklāt dažas Candida sugas, piemēram, C. krusei un C. glabrata, nav īpaši jutīgas pret flukonazolu. Klīnikā ļoti noderētu sēnīšu jutības pētījumi pret dažādiem pretsēnīšu līdzekļiem, taču vispārpieņemtas laboratorijas tehnikas šobrīd nepastāv.
Tāpat kā invazīvās aspergilozes gadījumā, izplatītās kandidozes diagnoze ir sarežģīta; diferenciāldiagnoze jāveic tāpat kā neitropēniskā drudža sindroma gadījumā. Diagnoze tiek noteikta, pamatojoties uz kandidēmijas noteikšanu, bet ne vairāk kā 60% akūtas diseminētas kandidozes gadījumu tiek atpazīti, izmantojot asins kultūras.
Papildus parastajai mikrobioloģiskajai pārbaudei ir izolāta līzes-centrifugēšanas metode, kas ir ierobežota izmantošana pacientiem ar neitropēniju. Dažas klīnikas papildus izmanto seroloģiskos testus (visbiežāk Cand-Tec?, Fa. Ramco), taču šo metožu efektivitāte nepārsniedz 50%, kā arī citas seroloģiskās metodes. Īpaši problemātiska ir šīs metodes izmantošana pacientiem ar novājinātu imunitāti. Kandidozes seroloģiskās pārbaudes nav ieteicamas pacientiem ar granulocitopēniju un AIDS. Pacientiem pēc aknu transplantācijas var izmantot seroloģisko metodi. Apmēram 10 gadus tiek veikti pētījumi par PCR diagnostikas izmantošanu pacientiem ar diseminēto kandidozi, tomēr šī metode vēl nav kļuvusi par ikdienu.
Hepato-lienal kandidoze, kas rodas pacientiem ar neitropēniju, parasti izpaužas pēc hematopoēzes atjaunošanas. Papildus pastāvīgam febrilam vai zemas pakāpes drudzim raksturīga hepato-lienal kandidozes pazīme ir līmeņa paaugstināšanās? -glikoroniltranspeptidāze un sārmainās fosfatāze asins serumā, kas liecina par holestāzi. Asins kultūras šādiem pacientiem gandrīz vienmēr ir neveiksmīgas. Ja ir aizdomas par nehepato-lienālo kandidozi, nepieciešams veikt vēdera dobuma datortomogrāfiju vai epigastriskā reģiona ultraskaņas izmeklēšanu (pēdējam ir jēga tikai tad, ja ir ļoti pieredzējis funkcionālais diagnosts). Turklāt magnētiskās rezonanses attēlveidošana ir efektīva un jāveic visos šaubīgos gadījumos. Aknu punkcijas biopsija, lai iegūtu materiālu mikrobioloģiskiem pētījumiem, bieži vien ir neefektīva, lai gan dažreiz diagnoze tiek veikta, pamatojoties uz biopsijas paraugu.
Tā kā vairumā gadījumu mēs runājam par kandidēmiju, kas saistīta ar centrālo venozo katetru (CVC), klīniski nestabiliem pacientiem CVC ir steidzami jānoņem. Ja pacients ir klīniski stabils, tad, pakļaujoties pilnai antimycotic terapijai, asinsradi var atjaunot līdz granulocītu līmenim 1,0x109/l un trombocītu līmenim 50x109/l, lai samazinātu asiņošanas risku. CVC noņemšana ir efektīvāka nekā tā nomaiņa “pa vadu”.
Amfotericīna B lietošanas taktika invazīvas kandidozes (kandidēmija, kandidozais ezofagīts un diseminēta infekcija) gadījumā ir gandrīz tāda pati kā invazīvai aspergilozei, bet zāļu deva ir 0,5 – 0,7 – (1,0?) mg/kg/dienā.
Vēl viena zāļu grupa gan virspusējas, gan invazīvas kandidozes (kandidēmijas un hepato-lienālās kandidozes) ārstēšanai ir azola atvasinājumi un galvenokārt flukonazols (Diflucan). Mūsdienu šo zāļu devas svārstās no 100 mg dienā (orofaringeālā kandidoze) līdz 800 mg dienā (izkliedētā kandidoze), un pat lielām devām ir mērena toksiska iedarbība.
Tā kā dažas Candida ģints sēnes, kas nav radniecīgas C. albicans sugai, ir vāji jutīgas pret flukonazolu, dzīvībai bīstamu stāvokļu gadījumā ir nepieciešama sākotnējā terapija ar amfotericīnu B, iespējams, pievienojot flucitozīnu. Ārstēšana ar flukonazolu tiek veikta pēc patogēna identificēšanas un pacienta stāvokļa stabilizācijas. Itrakonazola un vēl mazākā mērā ketokonazola (Nizoral) loma invazīvās kandidozes ārstēšanā pašlaik ir neskaidra un tiks noteikta pēc liela pētījuma par kandidozes profilaksi un ārstēšanu pabeigšanas.
Pamatojoties uz in vitro datiem par flucitozīna augsto efektivitāti pret dažādām Candida sugām, šīs zāles (75–100 mg/kg/dienā, sadalītas 4 devās) lieto kombinācijā ar amfotericīnu B. Šo zāļu sinerģisms pret daudzām sēnītēm ir. ir aprakstīts. Līdz šim lietotā deva 150 mg/kg/dienā ir pārāk liela un var izraisīt mielosupresiju, nekontrolējot koncentrāciju serumā. Terapeitiskā koncentrācija serumā ir 40-70 mcg/ml. Retas komplikācijas ir slikta dūša, vemšana, caureja līdz enterokolītam, aknu toksicitāte, eksantēma, kā arī centrālās nervu sistēmas komplikācijas (galvassāpes, apziņas traucējumi). Atkarībā no vietējās epidemioloģiskās situācijas aptuveni 5% ir primāri rezistenti pret flukonazolu (C. albicans). Šajā sakarā flucitozīns jālieto tikai kā daļa no kombinētās terapijas.
Kandidēmijas ārstēšanas ilgumam jābūt vismaz 14 dienām; izplatītai infekcijai - vismaz līdz bojājumu novēršanai. Katrā gadījumā terapijas ilgumu nosaka klīniskā situācija.
Attiecībā uz kandidozes, kā arī aspergilozes narkotiku profilaksi ir daudz autoritatīvu viedokļu, taču nav pieņemta standarta. Viena no invazīvās kandidozes sastopamības samazināšanas metodēm ir flukonazola perorāla lietošana (100–400 mg dienā). Šādas profilakses efektivitāte ir pierādīta tikai pacientiem pēc kaulu smadzeņu transplantācijas vai pēc aknu transplantācijas. Pacientiem ar akūtu leikēmiju un citām ļaundabīgām slimībām visbiežāk rodas virspusēja kandidoze, kuras gadījumā sistēmiskai flukonazola ievadīšanai nav priekšrocību salīdzinājumā ar lokālu amfotericīna B šķīduma vai suspensijas lietošanu (44, 45). Inducējot akūtas mieloleikozes remisiju, kā arī kaulu smadzeņu un cieto orgānu transplantācijas laikā, tiek nodrošināta profilakse ar flukonazolu vai, vismaz Vācijā, lokāla amfotericīna B (amfomoronāla) suspensijas lietošana. Citos gadījumos lēmums par pretsēnīšu zāļu izvēli jābalsta uz datiem par pacienta kolonizāciju ar Candida sēnītēm vai citiem patogēniem (skatīt “Pretsēnīšu profilakses algoritms pacientiem ar neitropēniju”).
Citas sēnīšu infekcijas
Lielākā daļa citu sēnīšu infekciju izpaužas kā lokalizēti orgānu bojājumi, piemēram, pneimonija, meningīts vai ādas bojājumi. Izplatītas mikozes rodas pacientiem ar smagu imūnsupresiju.
Kriptokokoze
Biežākie sēnīšu meningīta izraisītāji ir kriptokoki. Ir divu veidu patogēni: C.neoformans var. neoformans un C.neoformans var. gatii; otrā suga Eiropā nav sastopama. Abas sugas ir iekapsulētas raugam līdzīgas sēnes, kuras visbiežāk sastopamas augsnē un putnu izkārnījumos. Infekcija notiek, ieelpojot piesārņotu gaisu un putekļus. Pneimonija attīstās pacientiem ar imūndeficītu, visbiežāk tiem, kuri saņem imūnsupresīvu terapiju. Pēc pneimonijas (klīniski “nezināmas izcelsmes pneimonija”) parasti notiek diseminācija, kas izpaužas kā kriptokoku meningīts. Tipiski šāda meningīta simptomi ir galvassāpes, letarģija, paaugstināta intrakraniālā spiediena simptomi un galvaskausa nervu parēze. Meningisms tiek novērots apmēram pusei pacientu un vēl retāk pacientiem ar AIDS. HIV pozitīviem un HIV negatīviem pacientiem tika novērotas kriptokoku meningīta simptomu atšķirības (5. tabula).
5. tabula.
Kriptokoku meningīta klīniskās izpausmes HIV pozitīviem un HIV negatīviem pacientiem
Kriptokokozes diagnoze tiek noteikta, pamatojoties uz kriptokoku noteikšanu asins vai cerebrospinālā šķidruma kultūrās. Lumbālpunkcija parasti izraisa palielinātu cerebrospinālā šķidruma spiedienu. Liquorogramma parāda palielinātu citozi (pēc izvēles), palielinātu olbaltumvielu saturu un samazinātu glikozes saturu. Mikroskopiskā izmeklēšana var atklāt tipiskas iekapsulētas sēnīšu šūnas. Kriptokoku antigēns tiek konstatēts cerebrospinālajā šķidrumā un asinīs aptuveni 90% gadījumu šī metode joprojām ir vienkāršs un diezgan uzticams diagnostikas instruments, un to var izmantot, lai pārbaudītu, vai ir aizdomas par kriptokokozi. Ļoti jutīga diagnostikas metode ir arī cerebrospinālā šķidruma mikrobioloģiskā izmeklēšana, izmantojot īpašu barotni (piemēram, BACTEC).
Kriptokoku meningīts pacientiem ar novājinātu imūnsistēmu, piemēram, invazīva aspergiloze, bez ārstēšanas vienmēr izraisa pacienta nāvi, pat ja slimība ir subakūta. Agrīnai diagnostikai kopā ar citiem rādītājiem, piemēram, cerebrospinālā šķidruma spiedienam, ir svarīga prognostiska vērtība. Mirstība no kriptokoku meningīta ir augstāka, galvenokārt pacientiem ar imūndeficītu, kuri neslimo ar AIDS. Izvēles ārstēšana ir kombinācija: amfotericīns B (0,7–1,0 mg/kg/dienā) + flucitozīns (100–150 mg/kg/dienā, sadalīts 4 devās) + AIDS slimniekiem, flukonazols (400 mg/dienā) . Šī sākotnējā ārstēšana jāturpina vismaz 14 dienas, kam seko balstterapija ar 400 mg flukonazola dienā astoņas nedēļas. Vieglos gadījumos ir iespējama primārā monoterapija ar flukonazolu. Atveseļošanās iespējamība ir salīdzinoši zema. Ārstēšana jāturpina, līdz tiek sasniegta cerebrospinālā šķidruma mikrobioloģiskā dezinfekcija un kriptokokozes antigēnu titrs cerebrospinālajā šķidrumā samazinās līdz vērtībai 1:8 vai mazāk. Itrakonazols ir efektīvs arī pret kriptokoku meningītu un var būt alternatīva flukonazolam, taču jāņem vērā tā vājā iekļūšana asins-smadzeņu barjerā.
Kriptokokozes profilakse ir svarīga tikai pacientiem ar AIDS (CD4+ T-limfocīti< 0,2х109/л). В этих случаях стандартным методом профилактики является пожизненное назначение флюконазола в дозе 200 мг/сутки. Так как частота криптококкоза в различных регионах существенно варьирует, такую первичную профилактику криптококкоза проводят далеко не везде. В рандомизированном сравнительном исследовании эффективности профилактического применения флюконазола в дозе 200 мг/сутки и клотримазола у больных СПИД установлено достоверное снижение частоты криптококкового менингита при использовании флюконазола (0,9% против 7,1%) . Однако, поскольку криптококкоз в Германии встречается редко, его профилактика не является общепринятой.
Citas sēnīšu infekcijas ir reti sastopamas, tāpēc to diagnosticēšanai tiek izmantoti dažādu biosubstrātu (asins, šķidruma, audu) kultūras pētījumi un biopsijas paraugu histoloģiskā izmeklēšana. Seroloģiskie testi nav izstrādāti, izņemot histoplazmozi. Molekulāri bioloģiskie pētījumi šobrīd ir eksperimentālā stadijā.
Gandrīz visu oportūnistisko sēnīšu infekciju izvēle ir amfotericīna B + flucitozīna kombinācija vai monoterapija ar Ambisome. Amfotericīns B nav efektīvs pret Candida lusitaniae, Scedosporium spp. un tas nav īpaši efektīvs mikozes, ko izraisa zygomycetes, Trichosporon beigelii un Fusarium spp.
Empīriskā terapija nezināmas izcelsmes drudzim
Līdz šim aprakstītās ārstēšanas pieejas ir ieteicamas gadījumos, kad ir zināms infekcijas izraisītājs. Diezgan bieži, īpaši sēnīšu infekcijas agrīnajā periodā, izņemot fungemiju, nav iespējams noteikt patogēnu. Diagnozes grūtības un augstais mirstības līmenis pacientiem ar neitropēniju no invazīvām sēnīšu infekcijām, ko bieži atklāja tikai autopsijā, lika izstrādāt empīriskās pretsēnīšu terapijas koncepciju. To veic pret antibiotikām rezistenta febrila drudža gadījumos. Drudzis tiek uzskatīts par ugunsizturīgu, ja drudzis saglabājas 5–7 dienas, lietojot plaša spektra antibiotikas. Standarts šajā situācijā ir amfotericīna B lietošana devā 0,5–0,6 mg/kg/dienā. Daži pētījumi, tostarp tie, ko veica EORTC, ir parādījuši, ka šī empīriskā pretsēnīšu terapija var samazināt invazīvu sēnīšu infekciju sastopamību.
Daži salīdzinošie pētījumi liecina, ka flukonazolu var izmantot arī empīriskā terapijā. Tomēr Vācijā flukonazola lietošana šajā situācijā joprojām nav pieņemta, jo tam nav nekādas ietekmes pret aspergilozes patogēniem.
Kā alternatīva tiek pētīta iespēja izmantot Ambizom. Tādējādi mēs salīdzinājām Ambizom un amfotericīna B empīriskās lietošanas efektivitāti un toksicitāti pacientiem ar neitropēnisku drudzi, kas nav izturīgs pret antibiotikām. Tika pierādīts, ka, neraugoties uz salīdzināmiem pacientu kopējās dzīvildzes rādītājiem, Ambizom lietošana samazināja apstiprinātu sēnīšu infekciju sastopamību, samazināja febrilā drudža ilgumu un nefrotoksicitātes līmeni.
secinājumus
- Sasniegumi onkoloģisko un onkohematoloģisko slimību ārstēšanā, alogēnās un autologās kaulu smadzeņu transplantācijas, kā arī cieto orgānu transplantācijas izmantošana palielina vēža slimnieku atveseļošanās iespējas. Šīs terapijas ietvaros tiek izmantotas ne tikai citostatiskas, bet arī imūnsupresīvas zāles. Tāpēc sēnīšu infekcijas līmenis pastāvīgi palielinās gan pacientiem ar neitropēniju un/vai imūnsupresiju, gan citām pacientu grupām.
- Biežākie sēnīšu infekciju izraisītāji ir Aspergillus un Candida ģints oportūnistiskās sēnes; citi - Cryptococcus spp. un Fusarium spp., ir retāk sastopami. Invazīvām mikozēm raksturīga smaga gaita, dažādu orgānu un sistēmu bojājumi un ārkārtīgi sarežģīta diagnostika.
- Izvēlētās zāles ir amfotericīns B un Ambizom. Tie jālieto atbilstošās devās, iespējams, kombinācijā ar flucitozīna vai azola atvasinājumiem (flukonazolu, itrakonazolu utt.). Svarīgs nosacījums veiksmīgai ārstēšanai ir granulocītu līmeņa normalizēšana, ko var panākt, izmantojot granulocītu vai granulocītu-makrofāgu koloniju stimulējošus faktorus. Dažām infekcijām, tostarp invazīvai aspergilozei un citām mikozēm, kurām raksturīgs abscesa veidošanās, ir indicēta agrīna ķirurģiska iejaukšanās.
- Invazīvo mikozes profilakse ir indicēta pacientiem ar augstu risku. Līdztekus intensīviem pasākumiem, kuru mērķis ir samazināt kontaktus ar mikotiskos patogēniem, ieteicama agrīna empīriskā terapija ar amfotericīnu B.
Literatūra
- Fridkins, Džārviss. Nozokomiālo sēnīšu infekciju epidemioloģija // Clin. Microbiol. Rev.-1996.-Sēj. 9, N4.-P. 499–511.
- Bodijs, Bīlmans, Dugīds. Sēnīšu infekcijas vēža slimniekiem: starptautiska autopsijas aptauja // Eur. Clin. Mikrobiols.Inficēt. Dis.-1992.- Sēj. 11, N2.- P. 99 – 109.
- Groll, Shah, Mentzel, Schneider Jus-Nuebling, Huebner. Invazīvo sēnīšu infekciju pēcnāves epidemioloģijas tendences universitātes slimnīcā // J. Infect.-1996.-Vol. 33, N1.-P. 23-32.
- Rūnke, Beijers. Antimykotische Proрhylaxe bei neitropenischen und immunsupp-rimierten Patienten // Med. Kl.-1997.- Sēj.92.-P. 28-36.
- Bodijs, Vartivarian. Aspergiloze // Eur. Clin. Mikrobiols.Inficēt. Dis. –1989-Sēj.8.-P. 413-437.
- Abi-Said, Anaissie, Uzuna. Dažādu Candida sugu izraisītas hematogēnas kandidozes epidemioloģija // Clin. Inficēt.- 1997.-24.sēj., N6.-P. 1122–1128.
- Voss, Kluitmans, Kolemans. Rauga asinsrites infekciju rašanās laikā no 1987. līdz 1995. gadam piecās Nīderlandes universitātes slimnīcās // Eur. Clin. Mikrobiols.Inficēt. Dis. –1996.-Sēj. 15, N12.-P. 909–912.
- Ngujens, Pāvs, Moriss. Kandidēmijas mainīgā seja: ne Candida albicans sugu rašanās un pretsēnīšu rezistence // Am.J. med.- 1996.-Sēj. 100, N6.-P. 617–623.
- Vartivarian, Anaissie, Bodey. Jauni sēnīšu patogēni pacientiem ar novājinātu imunitāti: klasifikācija, diagnostika un vadība // Clin.Infect. Dis.- 1993.- Sēj. 17 (2. papildinājums).-P. 487-491.
- Pannuti, Gingrihs, Pfalers. Nozokomiālā pneimonija pieaugušiem pacientiem, kuriem tiek veikta kaulu smadzeņu transplantācija: 9 gadu pētījums // J. Clin. Onc.- 1991.-Sēj. 9, N1.-P.77 – 84.
- Fišmans, Rubīns. Infekcija orgānu transplantācijas saņēmējiem // N.Engl. J.Med.- 1998.- Vol. 338.-P. 1741.-1751.
- Makvinnijs, Kiblers, Hamons. Progress aspergilozes diagnostikā un ārstēšanā kaulu smadzeņu transplantācijā: 13 gadu pieredze// Clin.Infect. Dis. – 1993.-17.sēj.-P. 397–404.
- Valds, Leizenrings, Van-Buriks. Aspergillus infekciju epidemioloģija lielā pacientu grupā, kam tiek veikta kaulu smadzeņu transplantācija // Clin.Infect. Dis. –1997.-Sēj. 175, N6.-P. 1459. – 1466. gads.
- Darouiche .Orofaringeālā un barības vada kandidoze pacientiem ar novājinātu imunitāti: ārstēšanas jautājumi// Clin.Infect. Dis. –1998.-26.sēj.-P. 259-274.
- Gudrins, Rīds, Mori. Invazīvās kandidozes infekcijas klīniskās pazīmes un riska faktoru analīze pēc smadzeņu transplantācijas // Clin.Infect. Dis. –1991.-164.sēj.-P. 731–740.
- Balts, Cirrincione, Blevins. Kriptokoku meningīts: iznākums pacientiem ar AIDS un pacientiem ar neoplastisku slimību// Clin.Infect. Dis. –1992.- 165.sēj., N5.-P. 960–963.
- Morisons. Hroniskas limfoleikozes infekciozās komplikācijas // Semin. Oncol.- 1998.- 25.sēj., N1.-P. 98–106.
- LaRoko, Burgerts. Infekcijas kaulu smadzeņu transplantāta saņēmējā un mikrobioloģijas laboratorijas loma klīniskajā transplantācijā // Clin. mikrobiols. Rev.- 1997.-Sēj. 10, N2.-P. 277-297.
- Patels, Paja. Infekcijas cieto orgānu transplantācijas saņēmējiem // Clin. mikrobiols. Rev.- 1997.- 10.sēj., N 1.-P. 80–124.
- Anaissie, Bodijs, Edvards. Candida infekciju definīcijas // Ņujorka: Raven Press, 1993.-P. 407–408.
- Antilla, Elonens, Nordings. Hepatospleniskā kandidoze pacientiem ar akūtu leikēmiju: incidence and prognostis impplications // Clin.Infect Dis.- 1997.- Vol.24, N3.-P.375-380.
- Gersons, Talbots, Lūsks. Invazīvā plaušu aspergiloze pieaugušo akūtā leikēmijā: klīniskas norādes uz tās diagnozi // J. Clin. Onc. –1985.- Sēj.3.- P.1109-1116.
- Kūlmans, Fiskmans, Bērčs. Invazīvas plaušu aspergilozes CT //AJR Am. J. Roengenol.- 1988.- Vol.150, N 5.-P.1015 – 1020.
- Bretaņa, Kosta, Marmorat-Khuong. Aspergillus spesies DNS noteikšana bronhoalveolārajos skalošanas paraugos ar konkurētspējīgu PCR // J. Clin. Microbiol.- 1995.-Sēj. 33, N 5.-P. 1164-1168.
- Einsele, Hebarts, Rollers. Sēnīšu patogēnu noteikšana un identificēšana asinīs, izmantojot molekulārās zondes // J. Clin. Microbiol.- 1997.- Sēj. 35, N6.-P. 1353.–1360.
- Marina, Flinns, Rivera. Candida tropicals un Candida albicans fungemia bērniem ar leikēmiju // Cancer.- 1991.- Vol. 68, N3.-P.:594 – 589.
- Grēgers, Vīmens, Džeikobss. Lizes-centrifugēšanas asins kultivēšanas metodes lietderības trūkums fungēmijas noteikšanai vēža slimniekiem ar novājinātu imūnsistēmu // J. Clin. Mcrobiol.-1998.- Vol.36, N1.-P. 290-293.
- Takaki, Šimono, Išimaru. Candida antigēna un antivielu noteikšana serumā pacientiem ar invazīvu kandidozi// Int.J. Inficējiet. Dis.- 1996.- Sēj. 1, N2.- P.78 - 82.
- Klingspor, Stintzing, Tollemar. Dziļā Candida infekcija bērnu aknu transplantācijas saņēmējiem: seroloģiskā diagnoze un sastopamība// Acta Paediatr.- 1995.- Vol. 84, N4.-P. 424-428.
- Buhmans, Rosjē, Mercs. (Ķirurģisko patogēnu noteikšana ar in vitro DNS amplifikāciju. I daļa. Candida albicans ātra identifikācija sēnītei specifiska gēna amplifikācija in vitro //Ķirurģija.- 1990.- 108. sēj., N 2.-P. 338 – 347.
- Ātrums, Dunt. Klīniskās un saimniekorganisma atšķirības starp infekcijām ar divām Cryptococcus neoformans šķirnēm // Clin.Infect. Dis.- 1995.- Sēj. 21, N1.-P. 28-34.
- Čaks, Smiltis. Infekcijas ar Cryptococcus neoformans iegūtā imūndeficīta sindromā // N.Engl.J.Med. –1989.- Sēj. 321, N12.-P. 794–799.
- Denings, Stīvenss. Invazīvās aspergilozes pretsēnīšu un ķirurģiska ārstēšana: pārskats par 2121 publicētu gadījumu // Rev. Inficējiet. Dis. –1990.- sēj. 13, N2.- 345. lpp.
- Kukels, Broddens. Liposomālais amfotericīns B // Drugs.- 1998.- Vol. 55.-P. 585–612.
- Caillot, Kasasnovas, Bemard. Uzlabota invazīvās plaušu aspergilozes vadība neitropēniskiem pacientiem, izmantojot agrīnu krūšu kurvja datortomogrāfiju un ķirurģiju // J. Clin. Onc. –1997.- 15.sēj., N 1.-P. 139-147.
- Frensiss, Volšs. Flucitozīna lomas attīstība pacientiem ar novājinātu imūnsistēmu: jauni ieskati drošībā, farmakokinētikā un pretsēnīšu terapijā //Clin.Infect. Dis. –1992.-15.sēj., N6.-P. 1003-1018.
- Dismukes, Mākonis, Gallis. Kriptokoku meningīta ārstēšana ar amfotericīna B un flucitozīna kombināciju, salīdzinot ar sešām nedēļām // N.Engl.J.Med. –1987.- Sēj.317, N6.-P.334 – 341.
- Slimību kontroles un profilakses centri. Nozokomiālās pneimonijas profilakses vadlīnijas. Slimību kontroles un profilakses centri. MMWR Mord Mortal Wkly Rep 3. janvāris; 1997.-Sēj. 46(Rr-1).-P.1-79.
- Glasmacher, Molitor, Mezger. Pretsēnīšu profilakse ar itrakonazolu neitropēnijas pacientiem: farmakoloģiskie, mikrobioloģiskie un klīniskie aspekti // Mikozes.- 1996.- Sēj. 39.-P. 249-258.
- Beijers, Švarcs, Heinemans, Zīgerts. Invazīvās plaušu aspergilozes profilakses stratēģijas pacientiem ar imūnsupresiju vai neitropēniskiem pacientiem // Antimikrobs. Aģents. Ķīmiķis. –1994.- sēj. 38.-P. 911–917.
- Lortolorijs, Duponts. Pretsēnīšu profilakse neitropēnijas un imūndeficīta laikā // Clin. Microbiol.- 1997.- Vol. 10, N 3.-P. 477–504.
- Goodman, Winston, Greenfeld N. Kontrolēts pētījums par flukonazolu, lai novērstu sēnīšu infekcijas pacientiem, kuriem tiek veikta kaulu smadzeņu transplantācija// Engl.J.Med. – 1992.- Sēj.326, N13.-P.845 – 851.
- Lumbreras, Cuervas-Mons, Jara. Randomizēts pētījums par flukonazolu pret nistatīnu Candida infekciju profilaksei pēc aknu transplantācijas // Int.J. Inficēt. Dis. –1996.- 174.sēj., N3.-P. 583–588.
- Vinstons, Čandrasekāra. Flukonazola sēnīšu infekciju profilakse pacientiem ar akūtu leikēmiju. Randomizēta, placebo kontrolēta, dubultmaskēta, daudzcentru pētījuma rezultāti //Ann. Int. Med.- 1993.- Sēj. 118, N 7.-P. 495–503.
- Menčeti, Del-Favero, Martino. Sēnīšu infekcijas profilakse neitropēniskiem pacientiem ar akūtu leikēmiju: flukonazols salīdzinājumā ar perorālo amfotericīnu B // The GIEMA infekcijas programma.Ann. Int. Med. –1994.-120.sēj.-P. 913–918.
- Powderly, Finkenstein, Feinberg Randomizēts pētījums, kurā salīdzināja flukonazolu ar klotrimazola trošiem sēnīšu infekciju profilaksei pacientiem ar progresējošām cilvēka imūndeficīta vīrusa infekcijām. NIAID AIDS klīnisko pētījumu grupa // N.Engl.J.Med. –1995.- Sēj. 332, N11.-P. 700–705.
- Lakstīgala, Kals, Pētersons. Primārā profilakse ar flukonazolu pret sistēmiskām sēnīšu infekcijām HIV pozitīviem pacientiem // AIDS.- 1992.- Sēj. 6, N2.-P. 191-194.
- EORTC int.antimicrob.therapy coop.gr. Empīriskā pretsēnīšu terapija pacientiem ar febrilu granulocitopēniju. EORTC Starptautiskā pretmikrobu terapijas kooperatīvā grupa // Ann. J. Med.-1989.-Vol. 86, N6.-P. 688–672.
- Volšs, Finbergs, Ārndts. Liposomālais amfotericīns B empīriskai terapijai pacientiem ar pastāvīgu drudzi un neitropēniju // N.Engl.J.Med. –1999.- Sēj. 340.-P.764 – 771.
Sēnīšu otitis ir viens no ausu iekaisuma slimību veidiem, kad noteiktas daļas ietekmē rauga sēnītes. Saskaņā ar statistiku, slimība ir izplatīta. Pieaugušajiem tā tiek diagnosticēta 18,6% gadījumu, bet bērniem - 26% gadījumu. Slimībai ir cits nosaukums - otomikoze.
Slimības etioloģija
Vidusauss iekaisuma cēlonis bieži ir Aspergillus. Cukurs tam ir labs attīstības līdzeklis. Dažas sugas ir pielāgojušās dzīvei bez šī elementa.
Ņemiet vērā, ka auss kanālu vienlaikus aizsargā vairāki mehānismi. Vīrusiem un baktērijām tajā ir grūti iekļūt, jo tai ir vietēja imunitāte.
Pēdējo nodrošina tauku dziedzeru un sēra sekrēcija. Aizsardzības mehānismus var samazināt dažādu iemeslu dēļ, tas noved pie tā, ka sēnītes sāk ļoti ātri vairoties.
Cēloņi
Vietējās imunitātes samazināšanās notiek šādu iemeslu dēļ:
- bieža ūdens klātbūtne ausī,
- ādas traumas,
- vīrusu imūndeficīts.
Jūs varat saslimt ar otomikozi jebkurā vecumā. Daži cilvēki domā, ka, lai novērstu slimības attīstību, ir rūpīgi jākopj ausis un jātīra ar vates tamponiem. Pēdējie bieži izraisa auss gļotādas un ādas bojājumus.
Dažreiz tie izraisa slimības:
- peldēties saldūdens ūdenstilpēs,
- vielmaiņas slimība,
- vitamīnu trūkums.
Papildu iemesli ir svešķermeņa iekļūšana, pastiprināta svīšana un skrāpējumi niezes laikā.
Sēnīšu otīta simptomi
Otomikoze sākas ar taukainās aizsargplēves pazušanu, kas pārklāj gaļas dermu. Tas var būt saistīts ar mikrotraumu vai mitruma traucējumiem. Akūtā stadijā tiek novērota izdalīšanās. To apjoms katru dienu palielinās. Dažās situācijās pietūkums kļūst tik spēcīgs, ka auss kanāla lūmenis tiek pilnībā bloķēts. Tas izraisa troksni ausīs.
Pieaugušajiem
Iekaisumu dažreiz pavada limfadenīts un tas izplatās uz pieauss dziedzeri, templi un apakšžokļa locītavu. Dažreiz otomikoze ir ierobežota tikai ar ārējās auss bojājumiem. Pacientiem ar cukura diabētu bieži tiek ietekmēta vidusauss.
Pievērsiet uzmanību tādiem simptomiem kā:
- pietūkums,
- pietūkums, balti vai brūni izdalījumi,
- pilnības sajūta ausīs,
- dzirdes zaudēšana.
Fotoattēls par otomikozi cilvēkiem
Pazīmes bērnā
Šī otitis forma ir kļuvusi visizplatītākā maziem bērniem. Slimība parādās uz saaukstēšanās un vīrusu slimību fona, kā arī priekšlaicīgi dzimušiem zīdaiņiem un zīdaiņiem, kuri tiek baroti ar pudelīti.
Smagos gadījumos parādās ne tikai sāpes skartajā ausī un temperatūras paaugstināšanās, bet arī meningisma simptomi: vemšana, ekstremitāšu sasprindzinājums, galvas atgrūšana, fontanellu izvirzījums bērniem līdz viena gada vecumam. Bieži pavadošie simptomi ir apetītes trūkums, miega traucējumi un vaļīgāki izkārnījumi.
Svarīgs! Bērniem līdz 2-3 gadu vecumam ir grūti patstāvīgi noteikt diagnozi, tādēļ, parādoties simptomiem, bērns ir jāparāda ārstam.
Kā ārstēt?
Ārstēšana nekad nav ātra. Lai pilnībā atbrīvotos no simptomiem, parasti nepieciešamas 1-2 nedēļas. Bet ir viegli atvieglot sāpju sindromu neatkarīgi no tā, kad parādījās pirmās pazīmes. Galvenais noteikums bērniem un pieaugušajiem ir nodrošināt brīvu deguna elpošanu. Ja Jums ir iesnas, lietojiet ilgstošas darbības vazokonstriktorus.
Medikamenti
Labi darbojās pilieni un speciālās ziedes. Pirmie ietver “Anuaran”, “Dexon”. Īpašas ziedes un šķīdumi: "Nitrofungīns", "Travogen", "Microspor". Atkarībā no norādījumiem un bojājuma īpašībām tiek izvēlēta deva un lietošanas reižu skaits.
Ārstēšanai bieži vien pietiek ar vietējo medikamentu, piemēram, Otizol, lietošanu. Antibakteriālie līdzekļi tiek izvēlēti tikai tad, ja slimība ir daļa no sarežģītākas diagnostikas.
Pirms iepriekš minēto līdzekļu lietošanas nepieciešams notīrīt auss kanālu ar vates tamponiem. Ja izdalījumi ir bagātīgi, ausis mazgā ar furatsilīna šķīdumu. Rūpīga tualetes apmeklēšana un īpašu pilienu lietošana var mazināt pietūkumu un sāpes dažu dienu laikā.
Tautas aizsardzības līdzekļi
Tradicionālās metodes var būt daļa no vispārējās terapijas. Viņu ir daudz, katram ir īpašs efekts. Dažreiz cilvēki iztiek tikai šādos veidos. Populārākie ir:
- Bērzu pumpuru tinktūra. Ēdienu gatavošanai ievadiet 10 gramus. uz 200 ml degvīna. Kompozīcijai vajadzētu nostāvēties nedēļu. Kad tinktūra ir gatava, ar to jānoslauka auss un ausī jāievieto šajā šķīdumā samērcēts vates tampons.
- Propolisa tinktūra. Tas labi atvieglos sāpes. Pirms lietošanas to nedaudz sasildiet un iemetiet ausī. Pēc tam pārklāj to ar vati.
- Cukura dūmi. Uz skārda vāka jāuzber ēdamkarote cukura. Novietojiet to uz flīzes. Kad parādās dūmi, sarullējiet papīra gabalu caurulītē un novietojiet to virs dūmiem, otrs gals jānovirza uz skartās auss pusi. Procedūra ilgst 5 minūtes.
- Labs antibakteriāls līdzeklis pret sēnīšu infekcijām ir tējas koka eļļa.
Kas ir iespējams un kas nav
Nelietojiet antibiotikas bez ārsta receptes. Šādi pilieni nespēs iznīcināt sēnīti, un labvēlīgo mikroorganismu līmenis ievērojami samazināsies. Baktēriju otitis un otomikozes simptomi ir līdzīgi, tāpēc precīzu diagnozi noteiks tikai pieredzējis ārsts.
Pacientiem ir atļauts:
- notīriet ausis, izmantojot dezinfekcijas pilienus,
- noslaukiet ausi ar sodas šķīdumu,
- iekšķīgi lietojiet ārsta izrakstītos pretsēnīšu līdzekļus.
Ar otomikozi tas nav iespējams:
- sasildi ausi,
- pilienveida zāles, ko lieto cita veida vidusauss iekaisuma ārstēšanai,
- smēķē, ņem,
- ēst saldumus lielos daudzumos.
Par otomikozes briesmām, slimības ārstēšanu un profilaksi mūsu videoklipā:
Profilakse
Sēnīšu infekcijas bieži rodas cilvēkiem, kuri rūpīgi uzrauga savu higiēnu. Netīriet tos dziļi ar vates tamponiem, jo tas var viegli izraisīt infekciju. Kā profilakses pasākumi tiek izmantoti šādi līdzekļi:
- pareizu uzturu,
- vitamīnu kompleksi,
- izvairoties no ūdens iekļūšanas ausīs.
Nelietojiet ļaunprātīgi antibiotikas un hormonālās zāles. Tā kā sēnīšu otitis attīstās uz novājinātas imunitātes fona, profilakse sastāv no tā stiprināšanas. Šim nolūkam kursos tiek izmantoti imūnmodulatori.
Sievietes cieš no maksts sēnīšu infekcijām nevis pēc izvēles, bet gan normāla baktēriju līdzsvara traucējumu dēļ organismā, kas savukārt rada labvēlīgus apstākļus maksts baktēriju savairošanai, kas ražo rauga sēnīti.
Maksts nedrīkst palikt mitra ilgu laiku pēc menstruācijām vai dzimumakta, nav ieteicams mazgāt ar etiķi, jo tas var izraisīt veselīgu baktēriju iznīcināšanu maksts.
Candida Albicans ir rauga sēnītes, kas izraisa nopietnu infekciju, kas sākas gremošanas sistēmā un pakāpeniski izplatās uz citām ķermeņa daļām. Candida sēnītes atrodas mūsu organismā neilgi pēc dzimšanas. Tie parasti pastāv veselīgā līdzsvarā ar citām baktērijām un raugam līdzīgām sēnītēm zarnās. Noteiktos apstākļos, piemēram, stresa situācijā, kad imūnsistēma ir novājināta vai ilgstoši lietojot steroīdus, raugam līdzīgās sēnītes candida sāk vairoties, tādējādi izjaucot kuņģa-zarnu trakta floru. Candida aizaugšana var būt arī antibiotiku terapijas sekas, jo antibiotikas iznīcina ne tikai patogēnos organismus, bet arī lielu skaitu baktēriju, kas ir daļa no veselīgas kuņģa-zarnu trakta floras. Ja aizsargājošā zarnu flora ir traucēta un imūnā atbilde ir novājināta, šīs oportūnistiskās rauga sēnītes var izplatīties ārpus zarnām un jebkurā ķermeņa orgānā.
Ķīmiskās vielas, kas atrodamas maksts dušās, var kairināt maksts gļotādu un izjaukt normālu labo un slikto baktēriju līdzsvaru. Douching var arī izplatīt infekciju no maksts vai dzemdes kakla uz dzemdi, palielinot iegurņa iekaisuma slimības attīstības iespējamību. Iegurņa iekaisuma slimība ir sāpīga olvadu infekcija, kas var izraisīt neauglību. Lai novērstu smaku no maksts, ievērojiet personīgo higiēnu, izmantojot maigas ziepes un siltu ūdeni.
Plaša spektra antibiotiku lietošana iznīcina lielāko daļu labvēlīgo baktēriju zarnās, kas novērš Candida vairošanos. Daudzas sievietes zina, ka antibiotiku lietošana urīnpūšļa infekcijas gadījumā gandrīz vienmēr izraisa maksts rauga infekciju.
Candida Albicans sēņu savairošanos uz mēles var uztvert vienkārši kā kaitinošu lokālu augšanu. Oficiāli šo slimību sauc par "kandidozi". Bet paturiet prātā, ka pārāk pārklāta mēle var liecināt par candida klātbūtni. lielos daudzumos kuņģa-zarnu traktā un ārpus zarnām.
Galvenais ir pH līdzsvars organismā. Raugam līdzīga sēne organismā ir vienmēr, tikai dažādos daudzumos. Sēnīšu infekcija attīstās, kad organismā pazeminās pH-skābes līmenis. Imūnsistēma regulē skābju līdzsvaru organismā. Uzturs ir galvenais faktors, kas palīdz imūnsistēmai uzturēt veselīgu līdzsvaru. Normāls pH līmenis ir 6,4 (mērot urīnā vai siekalās). Jo vairāk jūsu faktiskais pH līmenis atšķiras no šī, jo jutīgāks esat pret dažādām slimībām un traucējumiem, jo īpaši sēnīšu infekcijām. Stress ir viens no galvenajiem pH nelīdzsvarotības cēloņiem organismā. Asins pH līmenis ir augstāks par ķermeņa pH. Traumas, liekais svars, antibiotiku un perorālo kontracepcijas līdzekļu lietošana ietekmē organisma dabisko pH līdzsvaru. Nogurums ir bieži aizmirsts stresa faktors. Visas dienas garumā pH līmenis nedaudz svārstās, bet vidēji tam vajadzētu būt 6,4.
Sēnīšu dermatīts ir ādas iekaisums, ko izraisa sēnīšu iekļūšana un turpmāka savairošanās dažādos tās slāņos. Slimība pieder dermatomikozes grupai. Tam ir infekciozi alerģisks raksturs, un tas ir pakļauts hroniskai recidivējošai gaitai, īpaši uz noteiktu predisponējošu faktoru fona.
Etioloģija
Sēnīšu dermatītu var izraisīt gandrīz visas cilvēkiem patogēnās un oportūnistiskās sēnītes. Daži no tiem ir daļa no normālas mikrofloras un pastāvīgi dzīvo uz ādas un gļotādu virsmas. Inficēšanās ar citiem notiek, sēnīšu sporām nokļūstot no ārpuses vai tiešā saskarē ar slima cilvēka skartajām ķermeņa zonām.
Kandidālais dermatīts ir visizplatītākais mikotiskās infekcijas veids bērniem un pieaugušajiem. Tas bieži vien ir domāts, runājot par ādas sēnīšu infekcijām. Šajā gadījumā dermatīts bieži tiek kombinēts ar gļotādu kandidozi.

1. cirkšņa kroku ādas kandidoze
2. Kandidozes autiņbiksīšu dermatīts
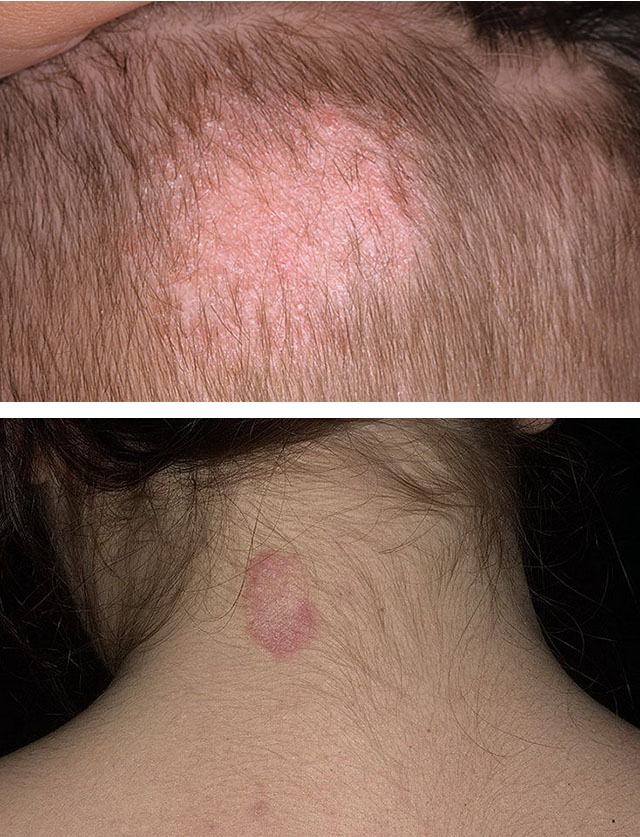
1. Trichophytosis
2. Mikrosporija
Predisponējoši faktori
Parasti āda ir nepārvarams šķērslis jebkuriem mikroorganismiem, tostarp visu veidu sēnītēm. To veicina daudzi faktori: sausuma un pārmērīga mitruma trūkums, epidermas integritāte, normāls skābums uz tās virsmas, imūnsistēmas funkcionālā integritāte. Jebkura no šiem nosacījumiem pārkāpšana var izraisīt dermas barjerfunkcijas samazināšanos, oportūnistiskās floras aktivizēšanos un sēnīšu iekļūšanu un vairošanos.
Ir daudzi predisponējoši faktori, kas palielina sēnīšu dermatīta attīstības iespējamību. Tie ietver:
- Atkārtoti un slikti dziedējoši epidermas mikrobojājumi. To veicina darba bīstamība (mehāniski ievainojumi, kontrastējošas temperatūras iedarbība, saskare ar kairinošām vielām), pārmērīgs roku ādas sausums neracionālas kopšanas dēļ, bieža mazgāšana un vietējo dezinfekcijas līdzekļu lietošana. Dažiem pacientiem epidermas integritātes pārkāpumus izraisa citas etioloģijas dermatīts (alerģisks, kontakts utt.).
- Paaugstināts ādas mitrums. Šis stāvoklis ir iespējams ar pārmērīgu svīšanu () liekā svara, endokrīno un neiroloģisku traucējumu, kā arī pacienta individuālo īpašību dēļ. Turklāt augstu mitrumu veicina ilgstoša individuālo ādas aizsarglīdzekļu nēsāšana ar zemu gaisa caurlaidību, ilgstoša uzturēšanās gumijas apavos, kā arī nepietiekami rūpīga ādas izžūšana pirms ģērbšanās pēc baseina, saunas, pirts apmeklējuma.
- Ķīmisko faktoru iedarbība. Piemēram, sēnīšu dermatīts zīdaiņiem bieži attīstās, ilgstoši saskaroties ar zīdaiņa ādu perianālajā zonā ar autiņbiksītēm, kas ir netīras ar urīnu un izkārnījumiem. Ir pierādīts, ka tieši epidermas macerācija urīnvielas sadalīšanās produktu un gremošanas enzīmu atlieku ietekmē veicina starpenes sēnīšu infekciju.
- Endokrīnās slimības. Nozīmīgākā patoloģija ir cukura diabēts, ko pavada ādas skābuma izmaiņas un pastiprināta mikroorganismu vairošanās.
- Samazināta imūnsistēmas reaktivitāte. Imūndeficītu var izraisīt HIV, smaga infekcija, citostatisko līdzekļu lietošana, staru terapija, noteiktas asins slimības, kaulu smadzeņu patoloģijas. Funkcionālie traucējumi iespējami arī stresa, neirotisku un afektīvu traucējumu, gremošanas sistēmas patoloģiju dēļ.
- Iracionāla antibiotiku terapija, kas izjauc dabiskās mikrofloras līdzsvaru un negatīvi ietekmē imūnsistēmas darbību.
- Ilgstoša lokālas un sistēmiskas iedarbības glikokortikosteroīdu zāļu lietošana, kas izraisa dishormonālus traucējumus un vietējo aizsargmehānismu aktivitātes samazināšanos. Tāpēc kandidozais dermatīts pieaugušajiem bieži rodas uz steroīdu terapijas fona sistēmisku saistaudu slimību un multiplās sklerozes gadījumā.
Ja ir vismaz viens no šiem faktoriem, sēnītes spēj pārvarēt dabisko ādas barjeru un var sākt aktīvi vairoties.
Patoģenēze
Ādas barjerfunkcijas pārkāpums palielina sēnīšu caurlaidību. Sākotnēji patogēni iekļūst virsmas keratīna slānī, mīkstinot un atslābinot to. Ja tas notiek vietās ar paaugstinātu keratinizāciju, pacients var pamanīt izmaiņas ādas biezumā un tekstūrā. Visās pārējās zonās šis posms notiek ātri un nemanāmi.
Aktīvi vairojoties un iegremdējot dziļi dermā, sēnītes veicina lokālu ādas izmaiņu parādīšanos un imūno mehānismu aktivizēšanos. Šūnu imunitāti galvenokārt izmanto, lai novērstu mikotisko infekciju. Tiesa, daudzos gadījumos tas paliek nepilnīgs un nenoved pie pilnīgas patogēna iznīcināšanas. Sēnīšu sensibilizācijas apstākļi veidojas, attīstoties specifiskām alerģiskām reakcijām. Tas izraisa pacienta stāvokļa pasliktināšanos, sekundāru izsitumu (micīdu) parādīšanos bojājuma perifērijā un pat attālumā no tā.
Papildu humorālās aizsardzības iekļaušana nespēj klīniski nozīmīgi ietekmēt sēnīšu dermatīta gaitu un neaizsargā no atkārtotas inficēšanās. Izgatavotās antivielas ir tipam nespecifiskas. Šī iemesla dēļ viltus pozitīvas reakcijas uz sēnītēm, kuras konkrētam pacientam netiek atklātas, ir diezgan izplatītas. Iespējamas arī krusteniskas seroloģiskas reakcijas pret dažiem epidermas faktoriem un pat IV grupas asins izoantigēniem.
Nepilnīgas imūnās reakcijas un liela alerģiju iespējamība ir faktori, kas veicina slimības atkārtošanos.
Epidemioloģija
Cik drošs ir sēnīšu infekcijas slimnieks citiem? Vai candida dermatīts ir lipīgs? Tieši par to tuvinieki parasti jautā ārstam.
Vesela cilvēka āda ir lielisks šķērslis visu veidu sēnītēm. Mikoze neattīstīsies pat bojājumu (nobrāzumu, skrāpējumu) klātbūtnē, ja cilvēkam nav citu predisponējošu faktoru. Vissvarīgākie no tiem ir imūndeficīta stāvokļi, nesena ilgstoša antibiotiku lietošana un latenta vai ārstēšanai nepieciešama cukura diabēta klātbūtne.
Izņēmums ir diezgan lipīga sēnīšu slimība, kas var attīstīties bez iepriekšējiem fona apstākļiem. Visos citos gadījumos, ja nav riska faktoru, nav jāuztraucas par infekciju pat ciešā tiešā saskarē ar
pacients. Dabiski aizsardzības mehānismi novērsīs dermatīta attīstību. Lai novērstu infekciju, ir pietiekami veikt tikai pamata nespecifisku profilaksi, nav nepieciešama nekādu zāļu lietošana.
Klīniskā aina
Sēnīšu dermatītu papildina tikai lokālu simptomu parādīšanās, nav raksturīgas vispārējas intoksikācijas izpausmes.
Galvenās slimības pazīmes ir:
- Diezgan skaidri izteiktu bojājumu parādīšanās uz ādas. Vairumā gadījumu tiem ir apaļa forma, bet, saplūstot, parādās bojājumi ar ģeogrāfisku rakstu. Mikotiskais fokuss atšķiras no apkārtējās veselīgas ādas ar epidermas krāsu un tekstūru, bieži vien tās perifērijā parādās tūsku audu izciļņi vai nelielu izsitumu mala.
- Izsitumi ar papulāru-pustulozu raksturu. Kad burbuļi atveras, veidojas garoza. Izsitumi var aprobežoties ar mikozes fokusu vai rasties zināmā attālumā no tā. Viņu izskats galvenokārt ir alerģisks. Tādēļ sēnīšu dermatīts bērniem var veicināt atopijas un diatēzes palielināšanos. Šajā gadījumā bērnam parādās raudāšana, izsitumi un garozas uz galvas, vaigiem, aiz ausīm un ekstremitāšu izliekumiem, kā arī var rasties zarnu darbības traucējumi.
- Atkarībā no patogēna veida skartā āda kļūst sausa un pārslveida vai raudoša. Pietūkums un autiņbiksīšu izsitumi ir kandidozes dermatīta simptomi. Citos gadījumos epidermu klāj zvīņas. Bet tajā pašā laikā bieži vien ir tendence uz vispārēju ādas mitruma palielināšanos.
- Ādas krāsas maiņa skartajā zonā - no spilgtas hiperēmijas līdz stagnējošai zilganai nokrāsai. Zīdaiņu kandidozo dermatītu pavada spilgts sēžamvietas un starpenes ādas apsārtums. Un rubrophytia noved pie diezgan tumšu plankumu parādīšanās.
- Parādās nieze. Bet daži sēnīšu dermatīti pacientam nerada acīmredzamu fizisku diskomfortu.
- Sāpes. Raksturīgs dermatītam ar aktīvu iekaisuma reakciju vai dermas dziļo slāņu bojājumiem. Sajūtas ir lokālas un pastiprinās ar mitrināšanu un berzi. Tos var raksturot kā intensīvas dedzināšanas sajūtu. Sāpes vienmēr pavada sēnīšu infekciju.
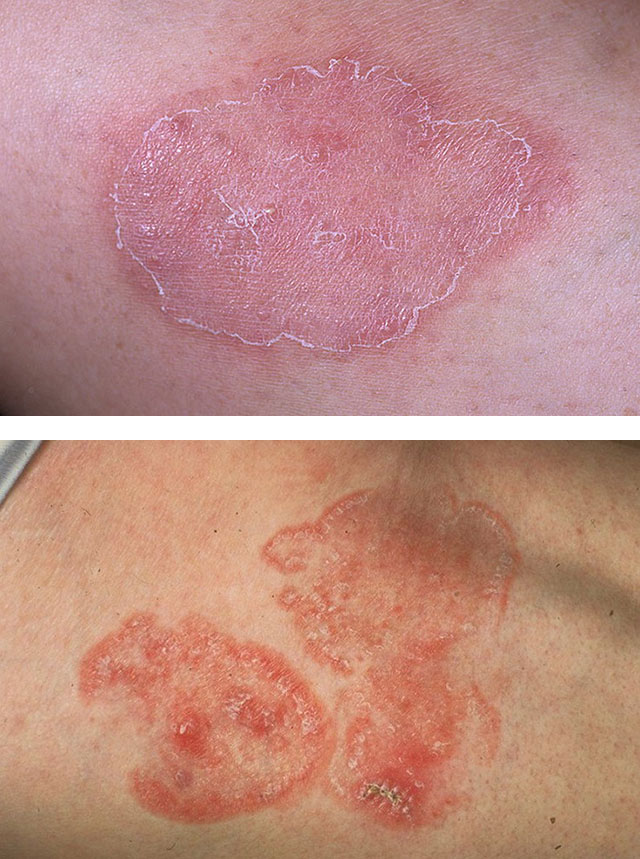

Gludas ādas mikoze
Diezgan smaga slimības gaita ir iespējama, attīstoties infiltratīvai-strutainai iekaisuma formai un pievienojoties sekundārai bakteriālai infekcijai.
Aptauja
Pacientu ar aizdomām par mikotiskas etioloģijas dermatītu pārbauda dermatologs. Šajā gadījumā, pārbaudot bojājumus uz skalpa un gludas ādas, tiek izmantota īpaša dienasgaismas spuldze. Bet ne visas mikozes dod raksturīgu mirdzumu. Turklāt daži no tiem sākotnēji neprasa šīs ierīces izmantošanu. Piemēram, lampa nav nepieciešama, ja inficējas ar rauga sēnītēm, jo kandidozais dermatīts izskatās diezgan raksturīgs.
Uzticams slimības sēnīšu etioloģijas apstiprinājums ir diagnozes pamatā. Tas ir iespējams, tikai veicot mikroskopisku biomateriāla izmeklēšanu, kas iegūta, iespiežot vai nokasot no bojājumiem. Galvenās apstiprinošās pazīmes ir micēlija vai raugam līdzīgu sēņu raksturīgo koloniju identificēšana. Tiek izmantota arī kultūras metode, kas ļauj iegūt pietiekamu daudzumu sēnīšu izpētei un ticami noteikt patogēna veidu.
Pacienta ar recidivējošu un īpaši progresējošu sēnīšu dermatītu izmeklēšanā jāiekļauj fona un predisponējošo faktoru noteikšana. Lai to izdarītu, tiek noteikta bioķīmiskā asins analīze, lai noteiktu glikozes līmeni, un, ja nepieciešams, tiek veikta cukura slodze. Arī HIV testēšana ir obligāta. Ārsts rūpīgi analizē arī visus medikamentus, ko pacients saņem, dažādu specialitāšu ārstu izrakstītas un bez atļaujas lietotas. Tiek precizēti higiēnas aspekti un darba bīstamības klātbūtne.
Kā ārstēt sēnīšu dermatītu
Sēnīšu dermatīta ārstēšana sākas tikai pēc laboratoriskas slimības etioloģijas apstiprināšanas. Šajā gadījumā tiek noteikti vietējas un sistēmiskas darbības pretsēnīšu līdzekļi, kas ļauj ietekmēt patogēnu visos ādas slāņos.
Galvenās zāles izvēle tiek veikta, ņemot vērā sēnītes veidu un tā jutīgumu. Ārsts var ieteikt lietot zāles ar plašu darbības spektru vai kuras iedarbojas tikai uz noteiktiem patogēniem. Ņemot vērā pretsēnīšu līdzekļu diezgan augsto iespējamo toksicitāti, nevajadzētu pārkāpt ieteicamo devu režīmu, patvaļīgi nomainīt zāles vai lietot jebkādus papildu līdzekļus sēnīšu dermatīta ārstēšanai.
Antihistamīna līdzekļi ir paredzēti, lai nomāktu alerģiskas reakcijas. Tāpat, ja iespējams, tiek pārtraukta zāļu lietošana, kas palīdz uzturēt sēnīšu infekciju: kortikosteroīdi, antibiotikas. Konstatētie ogļhidrātu vielmaiņas traucējumi ir jākoriģē. Vecākiem tiek mācīti zīdaiņu ādas kopšanas principi.
Profilakse
Sēnīšu dermatīta profilakse ietver visu predisponējošo faktoru likvidēšanu. Īpaši svarīga ir ārsta ieteikumu stingra ievērošana, veicot antibiotiku terapiju, cukura līmeņa korekcija asinīs, racionāla ādas kopšana un atteikšanās no lokālu glikokortikosteroīdu ilgstošas lietošanas.
Sēnīšu dermatīta pašatveseļošanās ir retāk sastopama. Bet kompetenta kompleksā terapija kopā ar fona un predisponējošu faktoru novēršanu var glābt pacientu no slimības. Bet nevajadzētu aizmirst, ka iepriekšējā mikotiskā infekcija neizraisa imunitātes veidošanos, turklāt nav iespējams pasargāt cilvēku no saskares ar patogēnām un oportūnistiskām sēnītēm. Tāpēc, kad tiek radīti labvēlīgi apstākļi, slimība var atkārtoties.
L.P. KotrejovaP.N. Kaškina vārdā nosauktais Medicīnas mikoloģijas pētniecības institūts, Sanktpēterburgas Medicīnas pēcdiploma izglītības akadēmija
Sēnīšu ETIOLOĢIJAS INTERTRIGO DIAGNOSTIKAS UN ĀRSTĒŠANAS ĪPAŠĪBAS L.P. Kotrehova
P.N. Kaškina Molekulārās medicīnas pētniecības institūts, Sanktpēterburgas Medicīnas akadēmijas pēcdip lome izglītības akadēmija
Katru gadu vasarā palielinās pacientu ar starptriginoziem ādas bojājumiem apmeklējumu skaits dermatoloģiskās medicīnas iestādēs. Intertrigo etioloģija ir dažāda. Visbiežāk sastopamie etioloģiskie faktori, kas izraisa ādas kroku bojājumu attīstību, ir patogēnās un oportūnistiskās sēnītes - ādas mikozes izraisītāji. Otrajā vietā starp intertrigo attīstības etioloģiskajiem faktoriem ir bakteriālas un bakteriālas-sēnīšu infekcijas. Autiņbiksīšu izsitumi, ko izraisa berze starp saskarē esošajām ādas virsmām, ir retāk sastopami. Un, kā likums, tā attīstību pavada sekundāra infekcija ar baktēriju vai sēnīšu biotu. Intertrigo sastopamība ir īpaši augsta pacientiem, kuri cieš no aptaukošanās un cukura diabēta. Faktori, kas veicina infekciozas etioloģijas (sēnīšu, baktēriju un baktēriju-sēnīšu) intertrigo rašanos, ir arī primārie un sekundārie imūndeficīta stāvokļi, ko izraisa cilvēka imūndeficīta vīruss, ilgstoša imūnsupresīvu zāļu, glikokortikosteroīdu lietošana utt. . Saslimstības ar mikozēm pieaugumu siltajā un karstajā sezonā veicina augsta apkārtējās vides temperatūra, augsts mitrums, nehigroskopisku un hermētisku apavu valkāšana, kā arī apģērbs no sintētiskiem materiāliem. Izsitumu atrašanās vieta ādas krokās tādās ādas slimībās kā psoriāze, atopiskais dermatīts, plakanais ķērpis, ekzēma un citas var atdarināt intertrigo.
Patoloģiskais process ar intertrigo ir lokalizēts roku un pēdu starppirkstu krokās, cirkšņa-augšstilba kaula, starpgluteālās krokās, padusēs un zem vēdera. Skartajās vietās parādās eritematozi, tūskas plankumi ar raudošām parādībām, epidermas macerāciju un plaisām. Tā kā jebkuras etioloģijas intertrigo gadījumā ādas bojājumu klīniskā aina ir gandrīz identiska (izņemot dažas nianses), pareizai diagnozei un etiotropās un patoģenētiskās terapijas izvēlei ir nepieciešama laboratoriskā diagnostika. Diagnostikas pasākumi ietver patoloģiskā materiāla, kas iegūts no bojājuma (ādas zvīņas, eksudāts, strutas), mikroskopisko un kultūras izmeklēšanu. Īpaši grūti diagnosticētos gadījumos viņi izmanto ādas histoloģisku izmeklēšanu.
Intertrigo ārstēšana tiek veikta saskaņā ar noteikto slimības etioloģiju, ņemot vērā patoģenētiskos faktorus, kas veicināja slimības attīstību. Mikozēm tiek nozīmētas vietējās pretsēnīšu zāles (alilamīnu, azolu un poliēnu atvasinājumi), bet plaši izplatītiem mikozes procesiem tiek izmantoti sistēmiski pretsēnīšu līdzekļi (terbinafīns, itrakonazols, flukonazols). Bakteriālu infekciju gadījumā izvēlētās zāles ir antibiotikas, gan vietējās, gan vispārējās. Izrakstot vietējo terapiju, liela nozīme tiek piešķirta pretsēnīšu zāļu zāļu formai (bāzei), jo bāzes, kas ir ļoti higroskopiskas, ar izteiktu pretiekaisuma, pretniezes un eksudāciju nomācošu iedarbību, ir optimālas intertrigo ārstēšanai. Pulveriem, šķīdumiem, aerosoliem un gēliem (Lamisil® Dermgel) ir šāda iedarbība. Krēmi ir mazāk pieņemami, jo dažos gadījumos tie var pastiprināt eksudācijas un raudāšanas procesus.
Mūsu pētījuma mērķis ir izpētīt intertrigo etioloģiju, galvenās saites patoģenēzē un klīniskajā gaitā, kā arī izstrādāt un novērtēt sēnīšu etioloģijas intertrigo pretsēnīšu terapijas efektivitāti, drošību un panesamību, kas ietver terbinafīns (Lamisil® Dermgel).
Metodes un materiāli
2005. gada 12 mēnešos intertrigo diagnoze tika noteikta 126 pacientiem, kuri vērsās pēc MM pētniecības institūta. P.N. Kaškina (79 sievietes, 47 vīrieši) vecumā no 18 līdz 92 gadiem (mediāna - 55 gadi). Visvairāk pacientu (54 cilvēki) ar intertrigooziem ādas bojājumiem konstatēti vasaras mēnešos un sastādīja 42,8% no visiem pagājušajā gadā pieteikušajiem pacientiem ar intertrigo. Intertrigo diagnoze tika noteikta, pamatojoties uz klīniskajām izpausmēm un ādas zvīņu mikroskopisko un kultūras pētījumu rezultātiem. Sēnīšu etioloģijas intertrigo konstatēts 85 (67%) pacientiem, bakteriāls - 21 (17%), bakteriāli sēnīšu etioloģijas - 17 (13%) pacientiem. 3 (2%) pacientiem tika diagnosticēts intertrigo, ko izraisīja saskarē esošo ādas virsmu berze.
Laboratorijas pētījuma rezultātā tika konstatēts, ka galvenie ādas mikozes izraisītāji pacientu grupā ar ierobežotiem vai atsevišķiem ādas bojājumiem ir dermatomicīti. Tie tika konstatēti 71% gadījumu, dermatomicīti kombinācijā ar Candida spp. vai pelējuma sēnītes - 12%, Candida spp - 17%. Dermatomicītu vidū dominēja T. rubrum. Tas tika izolēts 67% gadījumu, T. mentagrophytes - 12%, E. floccosum - 13%, Malassesia furfur - 8%. Ievērības cienīgs ir fakts, ka pacientu grupā ar ādas mikozēm, pievienojot piokoku floru, mikozes patogēnu attiecība ir atšķirīga. Dermatomicīti izolēti 45% gadījumu un 24% gadījumu - kopā ar Candida spp. ģints sēnēm. vai pelējuma sēnītes. Candida spp. 31% gadījumu bija mikozes attīstības cēlonis.
Strutojošā procesa izraisītāji bija: S. aureus - 38,1% gadījumu, S. pyogenes - 28,6%, S. viridans - 9,5%, Pseudomonas aeruginosa - 7,9%. S. aureus un S. viridans kombinācija konstatēta 12,7%, S. pyogenes un Pseudomonas aeruginosa - 3,2%.
Pacientu apskates rezultātā tika konstatētas blakusslimības. Endokrīnās slimības, tostarp cukura diabēts, tika novērotas 25% pacientu, aptaukošanās - 23%, sirds un asinsvadu sistēmas slimības - 20%, imūndeficīta stāvokļi - 7%, ādas slimības - 7% pacientu.
Zāļu forma Lamisil® Dermgel tika parakstīta 85 pacientiem ar mikozes procesa intertriginozo formu. Zāles tika uzklātas uz ādas, kas iepriekš notīrīta ar dezinfekcijas šķīdumiem, reizi dienā, līdz mikotiskais bojājums bija pilnībā izzudis. Pacienti ar jauktām baktēriju-sēnīšu infekcijām paralēli ārstēšanai ar Lamisil® Dermgel saņēma sistēmisku antibakteriālu terapiju ar plaša spektra antibiotikām (amoksicilīnu, cefaleksīnu utt.). Terapijas efektivitāte tika novērtēta, pamatojoties uz galveno klīnisko simptomu (nieze, eksudācija, hiperēmija, lobīšanās) izzušanas laiku un pēdu ādas zvīņu un nagu plākšņu mikroskopiskās un kultūras izmeklēšanas rezultātiem. Tika noteikts ārstēšanas ilgums ar Lamisil® Dermgel.
Pētījuma rezultāti
Pozitīvs rezultāts, lietojot Lamisil® Dermgel, tika novērots 12 stundas pēc terapijas sākuma: ievērojami samazinājās nieze, dedzināšana, hiperēmija un pietūkums. 2-3 dienu beigās visi pacienti pilnībā pārstāja raudāt, un 4 dienu beigās notika eroziju epitelizācija. Visi pacienti atzīmēja izteiktu dermgel atvēsinošu efektu un ātru simptomu, piemēram, niezes un dedzināšanas, izzušanu. Ārstēšanas ar Lamisil® Dermgel ilgums svārstījās no 7 līdz 15 dienām atkarībā no ādas bojājuma zonas un procesa lokalizācijas, un vidēji bija 10,3 ± 2,6 dienas. Šis vidējais ārstēšanas ilgums dažiem pacientiem ir saistīts ar vienlaicīgu slimību klātbūtni: cukura diabētu, aptaukošanos, kā arī imūndeficīta stāvokli, kas attīstījās saistībā ar steroīdu hormonu lietošanu.
Ārstēšanas rezultātā 79 (93%) pacientiem tika konstatēta ādas sēnīšu bojājumu pilnīga izzušana, 4 (5%) pacientiem tika konstatēts ievērojams ādas procesa uzlabojums, bet diviem (2,3%) zāļu lietošana tika pārtraukta. ) pacientiem nevēlamu notikumu rašanās dēļ. 12 (14%) pacientiem ādas mikozes recidīvi attīstījās dažādos laika periodos. Visi šie pacienti bija no riska grupām, cieta no diabēta, aptaukošanās vai imūndeficīta stāvokļiem. Visi pacienti atzīmēja labu zāļu panesamību. Blakusparādības ārstēšanas ar dermgel laikā tika novērotas 2 (2,3%) pacientiem, kuru dēļ bija jāpārtrauc zāļu lietošana. Vienam pacientam attīstījās toksikodermija, bet otram - alerģisks dermatīts.
Diskusija
Pētījuma rezultāti parādīja, ka intertrigo sastopamība palielinās siltajos un karstajos gadalaikos. Pacienti ar endokrīnām slimībām, cukura diabētu, aptaukošanos un imūndeficītu ir visvairāk pakļauti šai slimībai. Visbiežāk sastopamie intertrigo cēloņi ir sēnīšu, baktēriju un sēnīšu-bakteriālas infekcijas.
Lamisil® Dermgel (aktīvā viela terbinafīns) lietošanas rezultāti parādīja tā efektivitāti un drošību. Medikamenta Lamisil® Dermgel izvēle intertrigo sēnīšu etioloģijas pacientu ārstēšanai tika veikta, pamatojoties uz 1992. gadā veikto klīnisko pētījumu rezultātiem, kuru laikā tika pierādīts, ka terbinafīnam ir augsta fungicīda iedarbība pret visiem izplatītākajiem mikozes mikozes patogēniem. āda un tās piedēkļi. Pateicoties augstajai iespiešanās spējai, terbinafīns labi uzkrājas visos epidermas slāņos. Četras stundas pēc uzklāšanas uz ādas tā koncentrācija stratum corneum ievērojami pārsniedz minimālo inhibējošo koncentrāciju lielākajai daļai ādas mikozes patogēnu, kas dermatofītiem, piemēram, T. rubrum, ir aptuveni 0,003 μg/ml. Turklāt 7 dienas pēc ārstēšanas pārtraukšanas terbinafīna koncentrācija stratum corneum ir 0,33 ng/cm3, kas ir 100 reizes lielāka nekā koncentrācija, kas izraisa sēnītes nāvi. Tajā pašā laikā terbinafīna koncentrācija dermā ir zema, un tāpēc nav sistēmiskas ietekmes uz mikroorganismu. Zāles arī iedarbojas pret grampozitīvām un gramnegatīvām baktērijām, un tās antibakteriālās iedarbības ziņā nav zemākas par gentamicīnu. Tas dažos gadījumos ļauj to izmantot baktēriju-sēnīšu etioloģijas intertrigo ārstēšanā, neizmantojot antibiotikas.
Sēnīšu, baktēriju un baktēriju-sēnīšu etioloģijas intertrigo ārstēšanā liela nozīme ir lokālai lietošanai paredzēto zāļu medicīniskajam pamatam. Tas ir saistīts ar faktu, ka vairākas zāļu formas, piemēram, ziedes un krēmi, var veicināt tā sauktā “siltumnīcas efekta” attīstību un izraisīt pastiprinātu eksudāciju un infekcijas procesa tālāku izplatīšanos uz ādas. Šajā sakarā dermgel ārstnieciskā bāze ir optimāla intertrigo ārstēšanai. Tas ir ļoti higroskopisks, gaisa caurlaidīgs, un tam ir izteikta dzesēšanas un pretiekaisuma iedarbība, kas ļauj procesu atrisināt pēc iespējas īsākā laikā. Ne maza nozīme ir zāļu augstajai drošībai un labajai panesamībai, ko apstiprina daudzi klīniskie pētījumi, kas veikti dažādās valstīs.
secinājumus
- Visbiežākais intertrigo attīstības cēlonis ir ādas mikozes.
- Pacientiem ar sēnīšu etioloģijas intertrigo galvenie slimības izraisītāji ir dermatomicīti.
- Preparātam Lamisil® Dermgel ir izteikta pretsēnīšu, antibakteriāla un pretiekaisuma iedarbība, kā arī izteikta atvēsinoša iedarbība.
- Lietojot Lamisil® Dermgel, visi pacienti atzīmēja ātru iedarbības sākumu.
- Lamisil® Dermgel ir ļoti efektīvs, drošs un labi panesams pretsēnīšu līdzeklis.
LITERATŪRA
1. Ādas un veneriskās slimības. Direktorija. Ed. Ivanova O.L. M.: Medicīna.1997;3522. Korniševa VG. Ādas un zemādas audu mikozes, patoģenēze, klīniskā aina, ārstēšana: Abstract. diss. Dr. med. Sci. S.-Pb.:1998;34
Z. Potekaev NS, Potekaev NN, Rukavishnikova VM. Lamisil®: 10 gadi Krievijā. M.: 2003. gads
4. Raznatovsky KI, Rodionov AN, Kotrekhova LP. Dermatomikozes. SPb.: Izdevniecība SPbMAPO. 2003;159
5. Nolting S, Brautigam M. Terbinafīna pretmikrobu aktivitātes klīniskā nozīme Br J Dermatol.126 (suppl 39): 56-60
6.Hill S, Thomas R, Smith S, Finlay A. Farmakokinētiskais pētījums par 1% krēmu Lamisil. Br J Dermatol. 1992. gads; 127: 396^00
7. Khaldin AA, Sergejevs VYu, Izyumova IM. Mūsdienu idejas par cirkšņa dermatofitozi: etioloģija, epidemioloģija, klīniskā aina un efektīva terapija. Āda un vēnas pieauga. 2005;5:1-8





